Structure de lipase pancréatique, fonctions, valeurs normales
- 864
- 206
- Eva Henry
Le lipas pancréatiques (L'acyl-hydroly triacylglycérol) sont des enzymes sécrétées par le pancréas à l'intestin grêle et qui sont responsables de la digestion des triglycérides consommés dans l'alimentation, produisant des acides gras libres et du glycérol.
En d'autres termes, ce sont des enzymes qui digèrent les graisses, en particulier les graisses neutres, qui sont les plus abondantes de la nourriture (triglycérides). Ces graisses sont constituées d'un noyau de glycérol à laquelle trois molécules d'acide gras sont estérifiées.
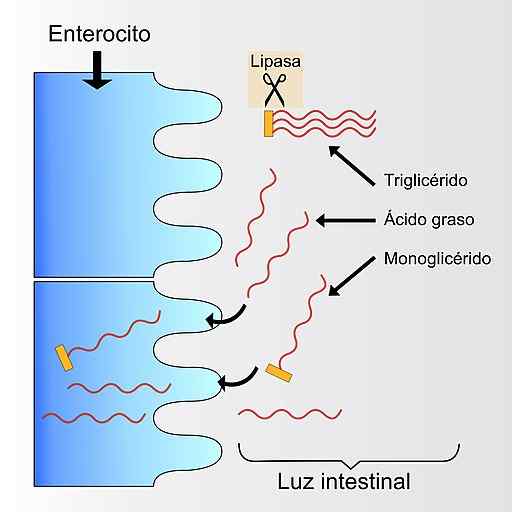
 Schéma graphique dans lequel le processus d'absorption des triglycérides est représenté par la paroi digestive du tube. La lipase pancréatique convertit les triglycérides en monoglycérides et acides gras libres (Source: possible2006 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Schéma graphique dans lequel le processus d'absorption des triglycérides est représenté par la paroi digestive du tube. La lipase pancréatique convertit les triglycérides en monoglycérides et acides gras libres (Source: possible2006 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Dans les sécrétions pancréatiques, d'autres enzymes qui dégradent les graisses sont également contenues et qui sont appelées phospholipases A et B, capables de dégrader les acides gras de la lécithine et de l'isticitine, respectivement.
Le pancréas est un organe à double fonction; D'une part, des hormones secrètes qui ont à voir avec le métabolisme des glucides (insuline et glucagon) et, d'autre part, enzymes secrètes pour la fonction digestive telles que les lipases (qui digèrent la graisse), les protéases (qui digèrent les protéines) et les Amilasas ( digestion des glucides).
Contrairement aux protéases, les lipases pancréatiques sont sécrétées à l'intestin grêle en tant que protéines actives et leur activité peut être augmentée en présence d'acides biliaires et d'autres composés.
Le jus pancréatique est non seulement composé d'enzymes, mais contient également du liquide et d'autres composants chimiques, tels que le bicarbonate par exemple, tous synthétisés par des cellules autres que le pancréas et sous des mécanismes de régulation stricts.
Certaines maladies pancréatiques sont caractérisées par un déficit enzymatique avec sécrétion de liquide normale ou vice versa, c'est-à-dire un déficit de sécrétion liquide et une sécrétion enzymatique normale.
Il peut vous servir: Dinerisme: caractéristiques, types, exemples[TOC]
Structure
Chez l'homme, la lipase pancréatique est une enzyme composée d'une seule chaîne polypeptidique, avec un poids moléculaire près de 50 kDa, similaire à l'enzyme de bovins, de moutons et de porcs.
Il s'agit d'une glycoprotéine qui a dans sa partie glucide de la main, de la fucosa, du galactose, du glucose et de la n-acétyl glucosamine. Chez l'homme, il a été proposé qu'il existe deux isoenzymes de la lipase pancréatique avec 5 points électriques de 5.80 et 5.85, respectivement.
Selon certaines études, cette enzyme est codée par un gène qui a environ 1.395 nucléotides, dont le produit translationnel correspond à une molécule d'environ 465 acides aminés.
L'extrémité N-terminale de la protéine complètement traitée et mature est précédée d'une séquence ou d'un peptide de 16 acides aminés hydrophobes, qui remplissent un rôle important dans la translocation de cette enzyme après sa synthèse.
L'enzyme des humains a un site actif situé à l'extrémité C-terminale, où il y a une triade d'acides aminés: Asp-His-Ser, dont la sérine semble être la plus importante catalytiquement parlant.
Activation et inhibition
Cette enzyme est sécrétée sous sa forme active, mais son activité augmente en présence d'acides aminés, d'ions calcium et de sels biliaires. Les sels biliaires, en particulier, sont responsables de la réduction du pH de la lumière intestinale de 8 de 8.1 à 6, qui est le pH optimal pour l'enzyme.
Certains auteurs soulignent que, si la concentration de sels biliaires augmente trop, la lipase pancréatique est inhibée, mais cette inhibition est contrecarrée ou inversée par une autre enzyme, la colipase, qui fonctionne comme un cofacteur de la lipase pancréatique et qui est codée par différents gènes au début.
Cependant, certains auteurs affirment que la lipase pancréatique, ainsi que les jus de pancréas phospholipase.
Peut vous servir: Saltacionisme: caractéristiques, preuves et exemplesIl a également été démontré que la présence excessive de sels de métaux lourds tels que le cuivre, le fer et le cobalt est inhibiteur pour la lipase pancréatique. Comme la présence d'halogènes, d'iode, de fluor et de brome.
Les fonctions
La fonction principale de l'enzyme de lipase pancréatique est de favoriser la digestion intestinale de triglycérides ingérés avec le régime alimentaire, une fonction qui parvient à hydrolyser ces composés et à libérer un mélange de diglycérides, de monoglycérides, d'acides gras libres et de molécules de glycérol.
En général, la lipase pancréatique hydrolyse les liens dans les positions 1 et 3 des triglycérides qui attaquent; Il catalyse également la digestion de certains esters synthétiques et, dans les deux cas, vous ne pouvez le faire qu'à l'interface entre l'eau et les graisses, donc le plus "fin" est une émulsion, il y a une plus grande activité Lipasa.
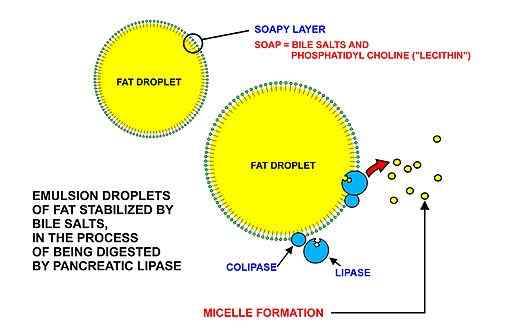 Schéma graphique des graisses ingérées par le régime alimentaire. Dans l'intestin, ceux-ci sont émulsifiés dans le duodénum par des solutions amphipatiques sous forme de sels biliaires et de phospholipides, qui peuvent ensuite être attaqués par la lipase pancréatique (source: Cruithne9 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Schéma graphique des graisses ingérées par le régime alimentaire. Dans l'intestin, ceux-ci sont émulsifiés dans le duodénum par des solutions amphipatiques sous forme de sels biliaires et de phospholipides, qui peuvent ensuite être attaqués par la lipase pancréatique (source: Cruithne9 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) La première étape de la digestion des graisses dans l'intestin grêle est leur «émulsification» dans le liquide intestinal, en raison de la présence de sels biliaires du foie et des mouvements péristaltiques intestinaux.
Il est important de noter que, dans le processus de digestion des graisses, les acides gras sans courts (entre 2 et 10 atomes de carbone) et les molécules de glycérol sont rapidement absorbés par la muqueuse intestinale.
Peut vous servir: parasitisme: concept, types et exemplesLes triglycérides, généralement caractérisés par la présence d'acides gras à longue chaîne (de plus de 12 atomes de carbone) sont digérés par des lipases pancréatiques une fois qu'elles ont "accueilli" dans des structures appelées mycelas, produit de l'émulsification.
Valeurs normales
Le pancréas, comme n'importe quel corps du corps, peut être soumis à différentes maladies d'origine infectieuse, inflammatoire, tumorale, toxique ou traumatique, qui peut avoir de graves implications pour le fonctionnement systémique.
Les enzymes à la lipase amilase et pancréatique sont souvent utilisées comme indicateurs sériques de certaines pathologies liées au système digestif et à leurs glandes accessoires.
Il a été prouvé que des niveaux élevés de lipases de lactosérum peuvent être dus à une pancréatite, et la même chose a été proposée en ce qui concerne une autre enzyme produite par le pancréas, l'amylase.
Les valeurs normales de la lipase pancréatique dans l'être humain sont comprises entre 0 et 160 U / L.
Le niveau de lipase pancréatique peut non seulement augmenter du sérum en raison de l'inflammation de la pancréatite chronique), mais cela peut également être une indication du cancer du pancréas, une gastro-entérite sévère, des ulcères duodénaux, des infections à VIH, etc.
Cela peut également se produire chez les personnes qui ont une carence familiale de lipoprotéine lipase.
Les références
- Meilleur, C. H., & Taylor, n. B. (1961). La base physiologique de la pratique médicale (Vol. 541). Baltimore: Williams & Wilkins.
- De cher, à., Figarella, C., Amic, j., Michel, R., & Mec, ou. (1977). Lipase pancréatique humaine: une glycoprotéine. Biochica et Biophysica Acta (BBA) -Protéine Structure, 490 (2), 411-419.
- Frank, B., & Gottlieb, k. (1999). Amylase normale, lipase élevée: est-ce une pancréatite? The American Journal of Gastroenterology, 94 (2), 463.
- Hall, J. ET. (2015). Guyton et Hall Textbook of Medical Physiology E-Book. Sciences de la santé Elsevier.
- Marcin, J. (2017). Healthline. Récupéré le 26 décembre 2019 de www.Healthline.com / santé / amylase-et-tests
- Ruche, t. C., Patton, H. D., & Howell, W. H. (1973). Physiologie et biophysique. Sauteuse.
- Winkler, F. K., d'Arcy, un., & Hunziker, w. (1990). Structure de la lipase pancréatique humaine. Nature, 343 (6260), 771.
- « Caractéristiques, maladies et diagnostics de l'Hososidérine
- Ictiosaure caractéristique, extinction, nourriture, reproduction, fossiles »

