Lipasa Caracatétisme, structure, types, fonctions
- 1980
- 523
- Lucas Schneider
Le lipasas Ils constituent une grande famille d'enzymes capables de catalyser l'hydrolyse des liaisons ester présentes dans des substrats tels que les triglycérides, les phospholipides, les esters de cholestérol et certaines vitamines.
Ils sont présents pratiquement dans tous les royaumes de la vie, à la fois dans les micro-organismes et les bactéries et les levures, comme dans les plantes et les animaux; Dans chaque type d'organisme, ces enzymes ont des propriétés et des caractéristiques spéciales qui les différencient les uns des autres.
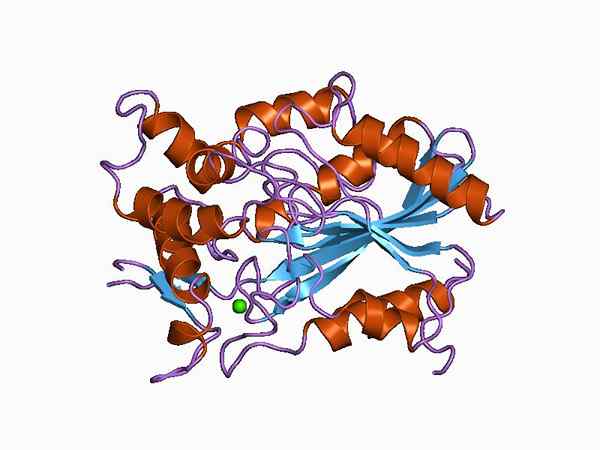
 Représentation graphique de la structure moléculaire d'une lipase (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons)
Représentation graphique de la structure moléculaire d'une lipase (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons) Selon le type de classification, la distinction peut être faite entre les «vrais» lipasas, également appelés lipas triacylglycérol et d'autres enzymes avec une activité lipolytique similaire telle que les phospholipases, l'esterol estéré et le rétinyl-pealmitate de site.
Le premier rapport publié de la séquence d'une enzyme lipase a été celui de De Caro et des collaborateurs en 1981, qui a étudié le pancréatique Triacilglycérol Lipasa des porcs. Des études ultérieures ont démontré l'existence de nombreuses autres lipases systémiques dans les organismes vivants.
Les lipases les plus importantes chez les animaux sont les lipases digestives produites par le pancréas et le foie, qui participent régulièrement au métabolisme des graisses consommées dans l'alimentation, et ont donc des implications physiologiques importantes de divers points de vue.
À l'heure actuelle, ces enzymes sont non seulement étudiées à des fins cliniques et / ou métaboliques, mais produisent également industriellement à des fins commerciales pour la transformation des aliments et d'autres produits, et peuvent être obtenues à partir de la culture de micro-organismes spéciaux.
[TOC]
Caractéristiques
Les lipasas sont des protéines solubles dans l'eau et catalysent les réactions hydrolytiques dans les substrats insolubles. Ils se trouvent dans la nature dans un équilibre entre leur forme active et leur forme inactive et leur activation ou leur inactivation dépend de différents facteurs internes.
Peut vous servir: Glucans: structure, caractéristiques et fonctionsIls appartiennent à la superfamille enzymatique hydrolysase avec des plis α / β, où les tapis, les thioesterae, certaines protéases et peroxydases, Defalus et d'autres hydrolases intracellulaires sont également classées.
Les lipases sont codées par des gènes qui appartiennent à une famille qui comprend les gènes codants de la lipase pancréatique, de la lipase hépatique, de la lipoprotéique lipase, de la lipase endothéliale et de la phosphatidylsérine phospholipase A1.
Mécanisme catalytique
Certains auteurs proposent que la forme de catalyse que ces enzymes ont est analogue à celle des protéases, qui est liée à la présence de trois déchets d'acides aminés spéciaux sur le site actif.
Le mécanisme d'hydrolyse implique la formation d'un complexe enzymatique-substrat (lipase: triglycéride), par la suite la formation d'un intermédiaire hémiacétal puis la libération d'un diacylglycéride et d'un acide gras.
La dernière étape de l'hydrolyse, la libération d'acide gras du site actif, se produit par un modèle connu sous le nom de modèle "catapulte", qui implique qu'après la clivaje ou la rupture de la liaison ester, l'acide gras est rapidement éjecté du site catalytique.
Spécificité du substrat
Les lipases peuvent être spécifiques et différencier les substrats tels que les triglycérides, les diacylglycérides, les monoglycérides et les phospholipides. Certains sont spécifiques dans les acides gras, c'est-à-dire en ce qui concerne leur longueur, leur degré de saturation, etc.
Ils peuvent également être sélectifs en termes de région où l'hydrolyse catalyse, cela signifie qu'ils peuvent avoir une spécificité de position par rapport au site auquel les molécules d'acide gras sont jointes au squelette de glycérol (dans l'un des trois carbones).
Structure
Ainsi que les autres membres de la famille enzymatique auxquels ils appartiennent, les lipases sont caractérisées par une topologie composée de feuilles α et β plaquées. Le site catalytique de ces enzymes est généralement composé d'une triade d'acides aminés: sérine, acide aspartique ou glutamique et histidine.
Peut vous servir: autopoïèseLa plupart des lipases sont des glycoprotéines qui, selon la taille de la partie glucidique, ont entre 50 et 70 kDa.
Lipase pancréatique humaine
Il a 449 déchets d'acides aminés et deux domaines distincts: un N-terminal, où le site catalytique et le pli caractéristique des hydrolases (α / β), et un autre C-terminal, plus petit et plus petit et considéré comme «auxiliaire», avec une structure appelé "sandwich β".
Son poids moléculaire se situe entre 45 et 53 kDa et son activité catalytique est plus élevée à des températures proches de 37 ° C et un pH entre 6 et 10 et 10.
Les fonctions
Selon l'organe où ils se trouvent chez les mammifères, par exemple, les lipases exercent des fonctions physiologiques quelque peu différentes.
Comme mentionné, il existe des lipasas spécifiques dans le pancréas, le foie, les ovaires et les glandes surrénales (dans les reins) et dans les tissus endothéliaux.
Les lipases hépatiques sont responsables du métabolisme des particules lipoprotéiques, qui sont complexes formées par des lipides et des protéines qui fonctionnent principalement dans le transport de triglycérides et de cholestérol entre les organes et les tissus.
Plus précisément, les lipases participent à l'hydrolyse ou à la libération d'acides gras des molécules de triglycérides contenues dans des lipoprotéines. Ceci est nécessaire pour extraire l'énergie de ces molécules ou pour les recycler, en les utilisant comme précurseurs dans la synthèse d'autres composés.
Les lipases endothéliales sont présentes dans le foie, les poumons, la thyroïde et dans les organes reproducteurs et l'expression de leurs gènes est régulée par différentes cytokines. Ces enzymes participent également au métabolisme des lipoprotéines.
Fonctions industrielles
Dans l'industrie des produits laitiers, l'utilisation des lipases est courante pour hydrolyser les graisses présentes dans le lait, qui a des effets directs sur la "potentialisation" de la saveur dans les fromages, les crèmes et autres produits laitiers.
Peut vous servir: Glycéraldéhyde 3-phosphate (G3P): Structure, fonctionsIls sont également utilisés dans la fabrication d'autres produits alimentaires, en particulier pendant la fermentation, afin d'améliorer le goût et la «digestibilité» de certains repas de préparation des aliments.
Loin de l'industrie alimentaire, l'utilisation de lipases d'origine microbienne est populaire dans la formulation de détergents et de substances de nettoyage généraux, ce qui diminue les effets délétères sur l'environnement qui implique l'énorme charge chimique présente dans les produits de nettoyage conventionnels.
Les références
- Lowe, M. ET. (2002). Les lipases triglycérides du pancréas. Journal of Lipid Research, 43, 2007-2016.
- Mead, J. R., Irvine, s. POUR., & Ramji, D. P. (2002). Lipoprotéine Lipase: structure, fonction, régulation et rôle dans la maladie. J. Mol. Médicament., 80, 753-769.
- Perret, B., Mabile, L., Martinez, L., Troisièmement, F., Barbaras, R., & Collet, x. (2002). Lipase hépatique: relation structure / fonction, synthèse et régulation. Journal of Lipid Research, 43, 1163-1169.
- Santamarina-Fojo, S., González-Navarro, H., Freeman, L., Wagner, E., Santamarina-Fojo, S., Gonza, H.,... non, z. (2004). Lipase hépatique, métabolisme des lipoprotéines et athérogenèse. Artériosclérose, thrombose et biologie vasculaire, 24, 1750-1754.
- Taylor, P., Kurtovic, je., Marshall, S. N., Zhao, x., Simpson, B. K., Kurtovic, je.,… Zhao, x. Toi. N. (2012). Lipases des mammifères et des poissons. Avis sur la science des pêches, 29, 37-41.
- « Définition des vecteurs non-copplanaires, conditions, exercices
- Définition des vecteurs équipocent, notation, exercices »

