Loi d'Henry

- 3332
- 592
- Louna Baron
 La loi d'Henry explique l'effermescence des boissons gazeuses
La loi d'Henry explique l'effermescence des boissons gazeuses Quelle est la loi d'Henry?
La Loi d'Henry C'est la relation qui décrit l'effet de la pression sur la solubilité du gaz. Cette loi établit que la solubilité d'un gaz en contact avec la surface d'un liquide à une température donnée est directement proportionnelle à la pression partielle dudit gaz sur le liquide.
Cela signifie que, plus la pression de gaz sur un liquide est grande, plus la quantité totale de gaz qui peut y être dissoute, obtenant ainsi une plus grande concentration (c'est-à-dire, plus la solubilité est grande).
La loi d'Henry, nous le voyons en action chaque fois que nous découvrons une boisson à la soude. Fermé, haute pression à l'intérieur de la bouteille maintient le gaz carbonique dissous. Mais en le découvrant, la pression du gaz diminue, ce qui réduit sa solubilité et s'échappe de la formation de bulles et d'effermescence.
Formule de droit d'Henry
Sous forme mathématique, la loi d'Henry est exprimée comme une loi de proportionnalité:
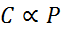
Cette loi de proportionnalité est transformée en:
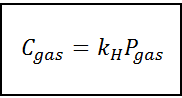
Où C Il se réfère à la concentration maximale de gaz dans le liquide, c'est-à-dire sa solubilité; Pgaz C'est la pression partielle du gaz en contact avec le liquide et kH C'est une constante de proportionnalité appelée Constante de la loi d'Henry.
La concentration en gaz peut être exprimée dans différentes unités telles que la molarité, la moléité ou la fraction molaire. Cependant, dans la plupart des cas, les produits chimiques utilisent la concentration dans les unités de molarité (en mol / L), tandis que la pression est exprimée dans les atmosphères.
Peut vous servir: Anthracène: ce qui est, la structure, les propriétés, les utilisationsLa constante de la loi d'Henry (kH)
La constante kH Décrire les interactions entre un gaz et un solvant. Plus ces interactions sont fortes, plus la constante et, par conséquent, sont importantes, plus la solubilité du gaz dans le solvant à une certaine température et pression.
Numériquement, la valeur de kH représente la solubilité du gaz à la température donnée, lorsque la pression partielle de la même chose est de 1 atm.
Selon les unités de concentration et de pression utilisées dans l'équation, cette constante peut avoir des unités MOL / L.atm, mol / kg.atm, etc.
Le tableau suivant montre les valeurs de la constante de la loi d'Henry pour certains gaz communs dans l'eau à 25 ° C:

Ces valeurs diminuent avec la température, car la solubilité des gaz en général diminue à une température plus élevée.
Explication de la loi d'Henry
La loi d'Henry est très facile à comprendre du point de vue microscopique. Nous pouvons imaginer un gaz comme un ensemble de très petites particules rebondissant sur toutes les surfaces qui jouent. Lorsqu'ils entrent en collision avec la surface d'un liquide, certaines particules rebondiront, tandis que d'autres traverseront la surface piégée (c'est-à-dire qu'elles se dissoudront).
Il en va de même pour les particules de gaz dissous. Ils rebondissent avec les murs du récipient et peuvent également atteindre la surface du liquide, où certains rebondiront tandis que d'autres traverseront la surface et s'échapperont à la phase gazeuse.
Lorsque l'équilibre est atteint, les vitesses auxquelles le gaz se dissout dans le solvant et avec lequel il les échappe sont égaux, donc la concentration reste constante.
Peut vous servir: propriétés mécaniques des métaux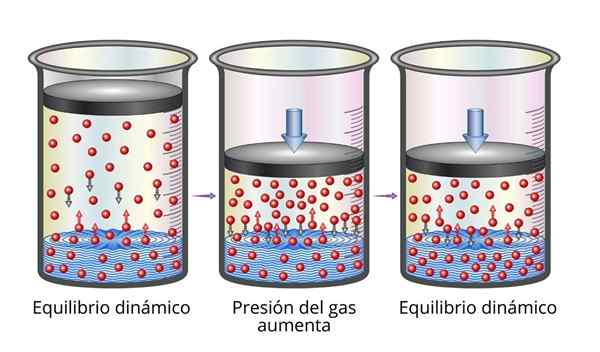 Explication de la loi d'Henry
Explication de la loi d'Henry Lorsque nous augmentons la pression du gaz, ce que nous faisons, c'est augmenter la fréquence à laquelle les particules de gaz entrent en collision avec la surface liquide. Cela fait la vitesse à laquelle le gaz se dissout augmente. Lorsqu'un nouvel équilibre est atteint, la nouvelle concentration de gaz sera plus grande.
Exceptions à la loi d'Henry
Il est important de souligner que la loi d'Henry est une loi idéale, qui ne décrit le comportement des solutions de gaz réelles dans certaines conditions. Ainsi, la loi d'Henry ne peut être appliquée que lorsque:
- La température reste constante.
- Le gaz est en équilibre avec la solution.
- La pression du gaz est relativement faible.
- Le gaz ne réagit pas avec le solvant.
Malgré cela, même dans certains cas où le gaz réagit avec le solvant, cette loi peut être appliquée approximativement.
Exemples d'application de la loi d'Henry
Exemple 1: Détermination de la constante de la loi d'Henry
Il a été déterminé expérimentalement que la concentration d'une solution aqueuse en équilibre avec un néon à une pression de 3,00 atm et 25 ° C est de 0,00135 mol / L. Déterminez la constante de la loi d'Henry pour le néon dans l'eau à 25 ° C.
Solution:
Selon la loi d'Henry:
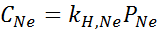
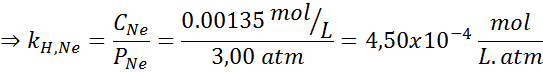
Par conséquent, la constante de la loi d'Henry pour le néon dans l'eau à 25 ° C est de 4,50 × 10-4 mol / L.AU M.
Exemple 2: Détermination de la solubilité d'un gaz
En utilisant la constante de la loi d'Henry prévue dans le tableau précédent, déterminez la solubilité du dioxyde de carbone de l'air dans l'eau au niveau de la mer, sachant que la fraction molaire dudit gaz dans l'air est de 3,14 × 10-4.
Solution:
Au niveau de la mer, la pression de l'air est de 1 atm et la pression partielle du CO2 Il est donné par:
Il peut vous servir: acide hypoyode (HIO)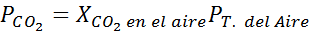
Remplacement de cette expression dans la loi d'Henry:
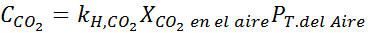
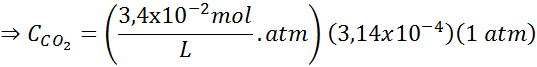
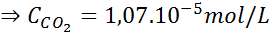
Exemple 3: gaz de plongée
Lorsqu'un plongeur rien à des profondeurs supérieurs à 30 mètres, un mélange d'air doit respirer avec d'autres gaz inertes tels que l'hélium ou l'argon, car l'augmentation de la concentration d'azote dans le sang prédit par la loi d'Henry a des effets narcotiques qui provoquent la désorientation, la confusion et la vision problèmes.
Cet effet commence à observer en respirant l'air (xN2= 0,78) à une pression de 4,00 atm. Si un plongeur prévoit de descendre jusqu'à 100 mètres de profondeur, où la pression est d'environ 11,0 atm, quelle est la fraction d'azote maximale qui peut respirer avant de souffrir de trafiquants de drogue?
Solution:
Sur la base de l'énoncé, nous pouvons déduire que la concentration maximale d'azote est ce qui se produit lorsque la pression de l'air est de 4,00 atm. Selon la loi d'Henry et l'utilisation de la relation entre la pression totale et la pression partielle de l'exemple précédent:
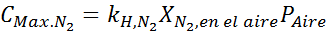
Cela doit être la même concentration maximale à n'importe quelle pression totale. Donc, 100 mètres:
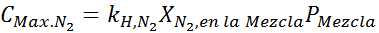
Égalisant les deux équations, nous pouvons trouver la fraction molaire maximale de l'azote dans le mélange:
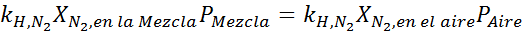
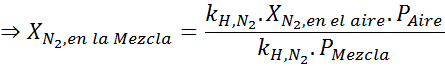
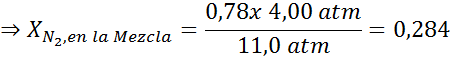
Cela signifie que le plongeur ne doit pas utiliser un mélange contenant plus de 28,4% d'azote s'il prévoit de plonger jusqu'à 100 mètres de profondeur.

