Structure des hormones stéroïdes, synthèse, mécanisme d'action
- 2620
- 201
- Justine Charpentier
Le Hormones stéroïdes Ce sont des substances faites par des glandes de sécrétion internes et qui se jettent directement dans le torrent circulatoire, ce qui les conduit aux tissus où ils exercent leurs effets physiologiques. Son nom générique dérive du fait de posséder un noyau de stéroïde dans sa structure de base.
Le cholestérol est la substance précurseur à partir de laquelle toutes les hormones stéroïdes sont synthétisées, qui sont regroupées en progestation (par exemple, progestérone), œstrogènes (stronation), androgènes (testostérone), glucocorticoïdes (cortisol), minéralocorticoïdes (aldostérone) et vitamine D.
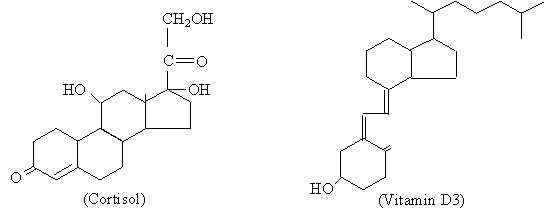
 Comparaison de la structure d'une hormone stéroïde (cortisol) avec une molécule de la même nature chimique (vitamine D3) (Source: le téléchargeur d'origine était Palladius à l'anglais Wikipedia. [Domaine public] via Wikimedia Commons)
Comparaison de la structure d'une hormone stéroïde (cortisol) avec une molécule de la même nature chimique (vitamine D3) (Source: le téléchargeur d'origine était Palladius à l'anglais Wikipedia. [Domaine public] via Wikimedia Commons) Bien que les différentes hormones stéroïdes présentent parmi les différences moléculaires qui sont celles qui confèrent leurs différentes propriétés fonctionnelles, on peut dire qu'ils ont une structure de base qui leur est commune et qui est représentée par le cyclopentanoperhydrofenantreno de 17 atomes de carbone.
[TOC]
Structure de stéroïdes
Les stéroïdes sont des composés organiques de nature très diversifiée qui ont en commun ce qui pourrait être considéré comme un noyau progéniteur composé de la fusion de trois anneaux de six atomes de carbone (cyclohexan) et l'un des cinq atomes de carbone (cyclopentano).
Cette structure est également connue sous le nom de "cyclopentanoperhydrofenantreno". Comme les anneaux sont unis mutuellement, le total des atomes de carbone qui le ralentissent est de 17; Cependant, la plupart des stéroïdes naturels.
 Schéma des quatre anneaux de la structure cycropique du cyclopentanoperhidrofenantreno (Source: Neurotokeker [domaine public] via Wikimedia Commons)
Schéma des quatre anneaux de la structure cycropique du cyclopentanoperhidrofenantreno (Source: Neurotokeker [domaine public] via Wikimedia Commons) De nombreux composés de stéroïdes naturels ont également un ou plusieurs groupes avec une fonction alcoolique et reçoivent donc le nom des stérols. Parmi eux se trouve le cholestérol, qui a une fonction d'alcool dans le carbone 3 et une chaîne d'hydrocarbures latérale de 8 atomes de carbone attachés au carbone 17; atomes numérotés de 20 à 27.
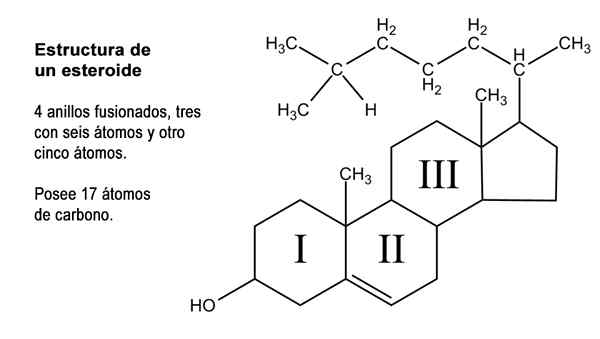 Structure d'un stéroïde. Image modifiée de marcotolo / cc by-s (https: // CreativeCommons.Org / licences / by-sa / 2.5)
Structure d'un stéroïde. Image modifiée de marcotolo / cc by-s (https: // CreativeCommons.Org / licences / by-sa / 2.5) En plus de ces 17 carbones, les hormones stéroïdes peuvent posséder dans leur structure 1, 2 ou 4 de plus de ces atomes, donc trois types de stéroïdes sont reconnus, à savoir: C21, C19 et C18.
C21
Le C21, comme la progestérone et les corticostéroïdes surrénaux (glucocorticoïdes et minéralocorticoïdes), sont dérivés de la "prégnale". Cela a 21 atomes de carbone car à 17 de l'anneau de base, les deux des groupes méthyle des carbones 13 et 10 sont ajoutés, et deux carbones de la chaîne latérale attachés au C17 qui, à l'origine, dans le cholestérol, il s'agissait de 8 carbones.
C19
Le C19 correspond aux hormones sexuelles avec une activité androgène et dérive de «l'androstano» (19 atomes de carbone), qui est la structure qui reste lorsque la prégnane perd les deux carbones de la chaîne latérale du C17, qui est remplacée par un hydroxyle ou Hydroxyl un groupe cétonique.
C18
Les stéroïdes C18 sont des hormones femelles ou œstrogènes qui sont principalement synthétisées dans les gonades femelles et dont la caractéristique proéminente, en ce qui concerne les deux autres types de stéroïdes, est l'absence de méthyle présent dans ce dernier lié au carbone en position 10.
Pendant la synthèse du cholestérol, des modifications enzymatiques sont produites qui modifient le nombre de carbones et favorisent la déshydrogénation et les hydroxilations de carbones spécifiques de la structure.
La synthèse
Les cellules productrices de l'hormone stéroïde sont principalement situées dans l'écorce des glandes surrénales, où les glucocorticoïdes tels que le cortisol, les minéralocorticoïdes tels que l'aldostérone et les hormones sexuelles masculines telles que la déshydroépiandrosteone et Androstena.
Les gonades sexuelles masculines sont responsables de la production d'androgènes qui incluent les hormones déjà mentionnées et la testostérone, tandis que les follicules ovariens qui atteignent la maturation produisent de la progestérone et des œstrogènes.
Peut vous servir: la moitié de la mienne: qu'est-ce que la fondation, la préparation, les utilisationsLa synthèse de toutes les hormones stéroïdes commence du cholestérol. Cette molécule peut être synthétisée par des hormones stéroïdes produisant des cellules, mais surtout ces cellules obtiennent des lipoprotéines de basse densité (LDL) présentes dans le plasma circulant.
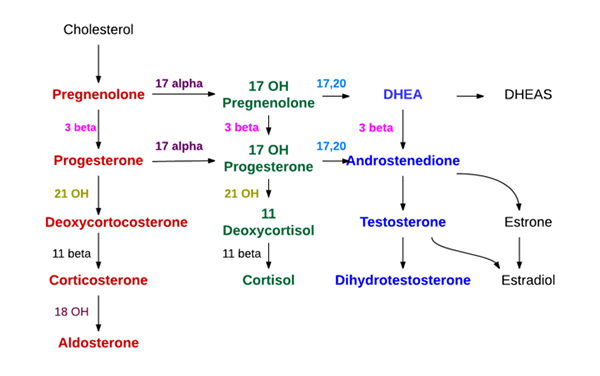 Synthèse des hormones surrénaliennes (Source: Endocrin Doctor [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Synthèse des hormones surrénaliennes (Source: Endocrin Doctor [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) - Synthèse au niveau du cortex surrénalien
Trois couches se distinguent dans le cortex surrénalien, connu de l'extérieur sous le nom de zones glomérulaires, fasciculaires et réticulaires, respectivement.
Dans le glomérulaire, ils sont des minéralocorticoïdes fondamentalement synthétisés (aldostérone), dans les glucocorticoïdes fasciculaires tels que la corticostérone et le cortisol, et dans les androgènes réticulaires tels que la déshydroepiandrosterone et l'androstène.
Synthèse des glucocorticoïdes
The first step in the synthesis occurs in the mitochondria and consists in the action of an enzyme called cholesterol demollase, belonging to the superfamily of the cytochrome P450 and also known as "P450SCC" or "CyP11A1", which promotes the elimination of 6 of The Atomes de carbone de la chaîne latérale attachés à C17.
Avec l'action de la démolase, le cholestérol (27 atomes de carbone) devient une prégnanolone, qui est un composé avec 21 atomes de carbone et représente le premier des stéroïdes de type C21.
La grossellienolone se déplace vers le réticulum endoplasmique lisse, où par action de l'enzyme 3β-hydroxiestoïde déshydrogénase.
Par l'action de la 21β-hydroxylase, également appelée «P450C21» ou «CYP21A2», la progestérone est une hydroxyle dans le carbone 21 et se transforme en 11-dexicorticostérone, qui revient à la mitochondrie, et à laquelle l'enzyme 11β-hydroxylase («», et à laquelle l'enzyme 11β-hydroxylase («», et à l'enzyme 11β-hydroxylase («», et à l'enzyme 11β-hydroxylase («», et à l'enzyme 11β-hydroxylase ("" P450C11 ”ou« CYP11B1 ») se convertit en corticostérone.
Une autre lignée de synthèse dans la zone fasciculaire et qui ne se termine pas dans la corticostérone, mais en cortisol, se produit lorsque la prégnanolone ou la progestérone est hydroxylée en position 17 par la 17α-hydroxylase («P450C17» ou «CYP17») et converti en 17-hydroxinolone ou 17-hydroxiprgesterone.
La même enzyme déjà mentionnée, la déshydrogénase de 3β-hydroxietéroïdes, qui convertit la prégnolone en progestérone, convertit également la 17-hydroxipnénolone dans la 17-hydroxiprgesterone.
Ce dernier est transporté successivement, par les deux dernières enzymes de la route qui produisent la corticostérone (21β-hydroxylase et la 11β-hydroxylase) en déoxyxicortisol et au cortisol, respectivement.
Actions de glucocorticoïdes
Les principaux glucocorticoïdes produits dans la zone fasciculaire du cortex surrénalien sont la corticostérone et le cortisol. Les deux substances, mais surtout le cortisol, affichent un large éventail d'actions qui affectent le métabolisme, le sang, la défense et les réponses de la cicatrisation des plaies, la minéralisation osseuse, le tube digestif, le système circulatoire et les poumons.
Quant au métabolisme, le cortisol stimule la lipolyse et la libération d'acides gras qui peuvent être utilisés dans le foie pour la formation de corps cétone à faible densité (LDL); diminue la collecte du glucose et la lipogenèse dans le tissu adipeux et la collecte et l'utilisation du glucose dans le muscle.
Il favorise également le catabolisme des protéines à la périphérie: dans le tissu du connecteur, le muscle et la matrice osseuse, qui est libéré des acides aminés qui peuvent être utilisés dans le foie pour la synthèse des protéines plasmatiques et de la gluconéogenèse. Stimule également l'absorption intestinale du glucose en augmentant la production de transporteurs SGLT1.
Accélérer l'absorption intestinale du glucose, la production hépatique augmentée et la diminution de l'utilisation de ces glucides dans le tissu musculaire et adipeux favorise une élévation des taux plasmatiques de glucose.
Quant au sang, le cortisol favorise le processus de coagulation, stimule la formation de neutrophiles et inhibe celui des éosinophiles, des basophiles, des monocytes et des lymphocytes t. Il inhibe également la libération des médiateurs de l'inflammation tels que les prostaglandines, les interleukines, les lymphocines, l'histamine et la sérotonine.
Peut vous servir: chimiorrecepteurEn líneas generales puede decirse que los glucocorticoides interfieren con la respuesta inmune, por lo cual pueden ser utilizados terapéuticamente en aquellos casos en los cuales esta respuesta es exagerada o inapropiada, como en el caso de las enfermedades autoinmunes o en los trasplantes de órganos para disminuir rejet.
- Synthèse des androgènes
La synthèse androgène au niveau du cortex surrénal est principalement au niveau de la zone réticulaire et du 17-hydroxipréolone et du 17-hydroxiprgesterone.
La même enzyme 17α-hydroxylase, qui produit les deux substances fraîchement mentionnées, a également une activité de liasa de 17,20, qui supprime les deux carbones de la chaîne latérale du C17 et les remplace par un groupe céto (= o).
Cette dernière action réduit le nombre de carbones et produit des stéroïdes de type C19. Si l'action se produit sur la 17-hydroxipnénolone, le résultat est la déshydroepiandrosterone; Si, au contraire, la substance affectée est l'hydroxiprgesterone, alors le produit sera l'androstène.
Les deux composés font partie des soi-disant 17-zosostéroïdes, car ils ont un groupe de cétone dans le carbone 17.
La 3β-hydroxisteroid déshygénase convertit également la déshydroépiandrosterone dans Androstene.
Synthèse des minéralocorticoïdes (aldostérone)
La zone glomérulaire n'a pas l'enzyme 17α-hydroxylase et ne peut pas synthétiser les précurseurs 17-hydroxiestéroïdes du cortisol et des hormones sexuelles. Il ne possède pas non plus la 11β-hydroxylase, mais une enzyme appelée aldostérone synthésase qui peut produire de la corticostérone séquentielle, du 18-hydroxychorique et du minéralocorticoïde de l'aldostérone.
Actions de minéralocorticoïdes
Le minéralocorticoïde le plus important est l'aldostérone synthétisée dans la zone glomérulaire du cortex surrénalien, mais les glucocorticoïdes présentent également l'activité des minéralocorticoïdes.
L'activité de minéralocorticoïde de l'aldostérone est développée au niveau de l'épithélium tubulaire des liquides du corps néphron distal.
- Synthèse de stéroïdes sexuels masculins dans les testicules
La synthèse testiculaire des androgènes se produit au niveau des cellules de Leydig. La testostérone est l'hormone androgène principale produite dans les testicules. Sa synthèse implique la production initiale d'Androsnediona comme décrit précédemment pour la synthèse des androgènes au niveau du cortex surrénalien.
Androsténeciona est converti en testostérone par l'action de l'enzyme 17β-hydroxiestoïde déshydrogénase, qui remplace le groupe cétone du carbone 17 par un groupe hydroxyle (OH).
Dans certains tissus qui servent d'objectif à la testostérone, cela est réduit par une 5α-réductase à la dihydrotestostérone, avec une plus grande puissance androgène.
- Synthèse de stéroïdes sexuels féminins dans les ovaires
Cette synthèse se produit cycliquement les changements qui se produisent pendant le cycle sexuel féminin. La synthèse se produit dans le follicule que pendant chaque cycle mature pour libérer un œuf puis produire le corps de lutéum correspondant.
Les œstrogènes sont synthétisés dans les cellules granuleuses du follicule mature. Le follicule mature a des cellules dans son teck qui produisent des androgènes tels que l'androstènediona et la testostérone.
Ces hormones se propagent aux cellules granulaires voisines, qui ont l'enzyme aromatase qui les rend stronation (E1) et 17β-stradiol (E2). D'après les deux, Striol est synthétisé.
Actions des stéroïdes sexuels
Les andogènes et les œstrogènes ont comme principale fonction le développement des personnages sexuels masculins et féminins respectivement. Les andogènes ont des effets anabolisants favorisant la synthèse des protéines structurelles, tandis que les œstrogènes favorisent le processus d'ossification.
Les œstrogènes et la progestérone libérés pendant le cycle sexuel féminin sont destinés.
Peut vous servir: flore et faune de Baja CaliforniaMécanisme d'action
Si vous devez actualiser la mémoire du mécanisme de l'action hormonale, il est recommandé de visualiser la vidéo suivante avant de continuer.
Le mécanisme d'action des hormones stéroïdes est assez similaire dans chacun d'eux. Dans le cas de composés lipophiles, ils se dissolvent sans difficulté dans la membrane lipidique et pénètrent le cytoplasme de leurs cellules blanches, qui ont des récepteurs cytoplasmiques spécifiques pour l'hormone à laquelle ils doivent répondre.
Une fois le complexe hormonal-récepteur formé, il traverse la membrane nucléaire et se joint au génome, à la manière d'un facteur de transcription, avec un élément de réponse à l'hormone (HRE) ou un gène de réponse primaire, qui à lui, vous pouvez réguler autres gènes de réponse secondaire.
Le résultat final est la promotion de la transcription et la synthèse des messagers d'ARN qui sont traduits dans les ribosomes du réticulum endoplasmique rugueux qui finissent par synthétiser les protéines induites par l'hormone.
Aldostérone comme exemple
 Molécule d'aldostérone
Molécule d'aldostérone L'action de l'aldostérone est exercée principalement au niveau de la partie finale du tube distal et dans les conduits de collecte, où l'hormone favorise la réabsorption de Na + et la sécrétion de K+.
Dans la membrane luminale des principales cellules tubulaires de cette région, il existe des canaux épithéliaux de canaux Na + et K + du type anglais (de l'anglais Tanne de potassium médullaire rénal).
La membrane basolatérale a des pompes Na + / K + ATPASA qui prennent en continu Na + de la cellule à l'espace interstitiel basolatéral et introduisent K + à l'intérieur de la cellule. Cette activité maintient la concentration intracellulaire de Na + très faible et favorise la création d'un gradient de concentration pour cet ion entre la lumière du tubule et la cellule.
Ce gradient permet au Na + de se déplacer vers la cellule à travers le canal épithélial, et à mesure que le Na + passe seul, pour chaque ion qui se déplace, il y a une charge négative non compensée qui fait que la lumière du tubulus devient négative par rapport à l'interstitium. C'est-à-dire qu'une différence de potentiel transepitelial est créée avec la lumière négative.
Cette négativité de la lumière favorise la sortie de K + qui s'est déplacée par sa plus grande concentration dans la cellule et la négativité de la lumière est sécrétée vers la lumière du tubule pour être enfin excrété. C'est cette activité de résorption Na + et la sécrétion de K + qui est régulée par l'action de l'aldostérone.
L'aldostérone présente dans le sang et libérée de la zone glomérulaire en réponse à l'action de l'angiotensine II, ou à l'hyperkaliémie, pénètre à l'intérieur des cellules principales et rejoint son récepteur intracitoplasmique.
Ce complexe atteint le noyau et favorise la transcription des gènes dont l'expression finira par augmenter la synthèse et l'activité des pompes Na + / K +, des canaux épithéliaux Na + et les canaux Romk de K +, ainsi que d'autres protéines plus. Réponse qui aura la rétention de Na + dans l'organisme et l'augmentation de l'excrétion urinaire de K+.
Les références
- Ganong WF: La médullaire surrénale et le cortex surrénalien, 25e Ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: hormones adrénocorticales, dans Manuel de physiologie médicale , 13e éd, AC Guyton, JE Hall (éd.). Philadelphie, Elsevier Inc., 2016.
- Lang F, Verrey F: Hormone, dans Physiologie des Menschen Pathophysiologie, 31 ed, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Voigt K: Système Endokrines, dans: Physiologie, 6e éd; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H et Strang KT: Physiologie de la reproduction féminine, dans la physiologie humaine de Vander: les mécanismes de la fonction corporelle, 13e éd; EP Widmaier et al (eds). New York, McGraw-Hill, 2014.
- « Coefficient de frottement statique, exemple, exercice
- Ampère Formula and Equations Law, démonstration, exercices »

