Structure hydrolasase, fonctions, exemples

- 3800
- 319
- Jade Duval
Le Hydrolase Ce sont des enzymes qui sont responsables de l'hydrolyzage de différents types de liens chimiques dans de nombreux composés différents. Parmi les principaux liens qui hydrolyz sont les liens ester, glucosides et peptidiques.
Au sein du groupe d'hydrolases, plus de 200 enzymes différentes ont été classées, regroupées au moins 13 ensembles individuels; Sa classification est essentiellement basée sur le type de composé chimique qui sert de substrat.
 Modélisation graphique avec des outils de bioinformatique de la structure d'une hydrolase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) via Wikimedia Commons)
Modélisation graphique avec des outils de bioinformatique de la structure d'une hydrolase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) via Wikimedia Commons) Les hydrolases sont indispensables pour la digestion des aliments dans l'intestin des animaux, car ils sont responsables de la dégradation d'une grande partie des liens qui composent les structures gazéifiées des aliments qu'ils ingèrent.
Ces enzymes fonctionnent dans des milieux aqueux, car ils ont besoin de molécules d'eau autour d'eux pour ajouter aux composés une fois que les molécules sont divisées. En termes simples, les hydrolases effectuent une catalyse hydrolytique des composés sur lesquels ils agissent.
Par exemple, lorsqu'une hydrolase brise une liaison covalente C-C, le résultat est généralement un groupe C-O et un groupe C-H.
[TOC]
Structure
Comme de nombreuses enzymes, les hydrolases sont des protéines globulaires organisées dans des structures complexes qui sont organisées par des interactions intramoléculaires.
Les hydrolases, comme toutes les enzymes, se lient à une ou plusieurs molécules de substrat dans une région de sa structure connue sous le nom de "site actif". Ce site est une poche ou une fente entourée de nombreux résidus d'acides aminés qui facilitent l'adhérence ou l'union du substrat.
Chaque type d'hydrolase est spécifique pour un substrat donné, qui est déterminé par sa structure tertiaire et par la formation d'acides aminés qui font leur place active. Cette spécificité a été soulevée didactiquement par Emil Fischer comme une sorte de "clé et verrouillage".
Peut vous servir: polymérase: caractéristiques, structure et fonctionsÀ l'heure actuelle, il est connu que le substrat, en général, induit des changements ou des distorsions dans la formation d'enzymes et que les enzymes, à leur tour, déforment la structure du substrat pour s'assurer que cette «dentelle» dans son site actif.
Les fonctions
Toutes les hydrolases ont la fonction principale de briser les liaisons chimiques entre deux composés ou dans la structure de la même molécule.
Il existe des hydrolases pour briser presque tous les types de liens: certains dégradent les liaisons d'ester entre les glucides, d'autres liaisons peptidiques entre les acides aminés protéiques, d'autres liaisons carboxyliques, etc.
Le but du processus de liaison chimique catalysée par une enzyme hydrolase varie considérablement. Smozyme, par exemple, est responsable de l'hydrolyse des liaisons chimiques à des fins de protection des organismes qui le synthétisent.
Cette enzyme dégrade les liens qui restent avec les composés de la paroi cellulaire des bactéries, dans le but de protéger le corps humain contre la prolifération bactérienne et une éventuelle infection.
Les nucléas sont des enzymes «phosphatase» qui ont la capacité de dégrader les acides nucléiques, qui peuvent également représenter un mécanisme de défense cellulaire contre l'ADN ou l'ARN.
D'autres hydrolases, telles que celles du type "protéases", dégradent les liaisons peptidiques des protéines dans le tube digestif pour rendre les acides aminés assimilables dans l'épithélium gastro-intestinal.
Même les hydrolases sont impliquées dans divers événements de production d'énergie dans le métabolisme cellulaire, car les phosphatases catalysent la libération de molécules de phosphate de substrats à haute énergie tels que le pyruvate, en glycolyse.
Il peut vous servir: l'adhérence du sojaExemples d'hydrolasases
Parmi la grande diversité des hydrolases que les scientifiques ont identifiées, certains ont été étudiés avec plus d'attention que d'autres, car ils sont impliqués dans de nombreux processus essentiels pour la vie cellulaire.
Parmi ceux-ci figurent la douceur, la protéase sérine, les phosphatases endonucléaires et glucosidases ou glycosyrae.
La douceur
Enzymes de ce type Break. Cela finit généralement par provoquer une lyse totale des bactéries.
Les smozymes défendent le corps des animaux des infections bactériennes et sont abondantes dans les sécrétions corporelles dans les tissus qui sont en contact avec l'environnement, comme, par exemple, des larmes, de la salive et des mucusités.
L'œuf de poulet lisse était la première structure protéique qui a cristallisé à travers les rayons x. Cette cristallisation a été faite par David Phillips, en 1965, au London Real Institute.
Le site actif de cette enzyme est composé de l'asparagine-alanine-mécanine-peasparagine-glycine-glycine-peragine-peptide-méthionine (nam-nag-nam).
Protease Serin
Les enzymes de ce groupe sont responsables de l'hydrolyzage des liaisons peptidiques dans les peptides et les protéines. Les plus fréquemment étudiées sont la trpsine et la chimotripsin; Cependant, il existe de nombreux types de protéases, qui varient en ce qui concerne la spécificité du substrat et son mécanisme de catalyse.
Les "protéases" sont caractérisées par la possession d'un acide aminé nucléophile de type sérine. Proteasas Serin est également capable de briser une grande variété de liens d'ester.
Peut vous servir: quelle est la composition chimique des êtres vivants?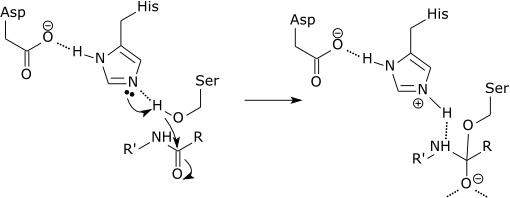 Schéma graphique de l'action d'une protéase qui brise un lien peptidique dans l'acide aminé histidine (Source: Zephyris à la langue anglaise Wikipedia [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)] via Wikimedia Commons)
Schéma graphique de l'action d'une protéase qui brise un lien peptidique dans l'acide aminé histidine (Source: Zephyris à la langue anglaise Wikipedia [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /)] via Wikimedia Commons) Ces enzymes coupent les peptides et les protéines de manière non spécifique. Cependant, tous les peptides et protéines à couper doivent être liés par l'extrémité N-terminale de la liaison peptidique avec le site actif de l'enzyme.
Chaque protéase courte est avec précision la liaison Amida qui se forme entre l'extrémité C-terminale de l'acide aminé à l'extrémité carboxyle et l'amine amineo qui est vers l'extrémité N-terminale du peptide.
Nucléase phosphatases
Ces enzymes Catalogue. Il existe de nombreux types différents de ces enzymes, car ils sont spécifiques au type d'acide nucléique et au site de coupe.
 Schéma graphique de l'action d'une endonucléase hydrolyzant une liaison phosphodiéster (Source: J3d3 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Schéma graphique de l'action d'une endonucléase hydrolyzant une liaison phosphodiéster (Source: J3d3 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Les endonucléases sont indispensables dans le domaine de la biotechnologie, car ils permettent aux scientifiques de modifier les génomes des organismes en coupant et en remplaçant les fragments des informations génétiques de presque toutes les cellules.
Les endonucléases font la coupe des bases azotées en trois étapes. Le premier est à travers un acide aminé nucléophile, puis une structure intermédiaire est formée avec une charge négative qui attire le groupe phosphate et brise enfin le lien entre les deux bases.
Les références
- Davies, G., & Henrissat, b. (Année mille neuf cents quatre-vingts-quinze). Structures et mécanismes des hydrolas glycosyles. Structure, 3 (9), 853-859.
- Lehninger, un. L., Nelson, D. L., Cox, M. M., & Cox, M. M. (2005). Principes de lehninger de la biochimie. Macmillan.
- Mathews, un. P. (1936). Principes de biochimie. W. Bois.
- Murray, R. K., Granner, D. K., Mayes, P., & Rodwell, V. (2009). Biochimie illustrée de Harper. 28 (P. 588). New York: McGraw-Hill.
- Ollis, D. L., Cheeah, e., Cygler, m., Dijkstra, b., Follow, f., Franken, s. M.,… & Sussman, J. L. (1992). Le pli α / β hydrolase. Protéine d'ingénierie, conception et sélection, 5 (3), 197-211.

