Hydratie
- 3946
- 201
- Paul Dumas
Que sont l'hydrace?
Les Hydratie, o Les acides binaires sont des composés dissous dans l'eau composée d'hydrogène et d'un élément non métallique: halogénures d'hydrogène. Sa formule chimique générale peut être exprimée en HX, où H est l'atome d'hydrogène, et x l'élément non métallique.
X peut appartenir au groupe 17, aux halogènes ou aux éléments du groupe 16 sans inclure l'oxygène. Contrairement aux oxoacides, les hydracides manquent d'oxygène. Étant donné que les hydraceides sont des composés covalents ou moléculaires, la liaison H-X doit être considérée. Ceci est d'une grande importance et définit les caractéristiques de chaque hydratie.
Lien h-x
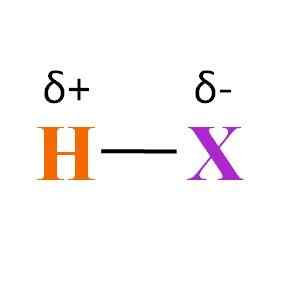 Formule chimique générale d'une hydratie. Source: Gabriel Bolívar
Formule chimique générale d'une hydratie. Source: Gabriel Bolívar Que peut-on dire du lien H-X? Comme on peut le voir dans l'image supérieure, il existe un produit de moment dipolaire permanent des différentes électronégativités entre H et X. Parce que x est généralement plus électronégatif que H, il attire son nuage électronique et se termine par une charge partielle négative δ-.
Au lieu de cela, lorsqu'il donne une partie de sa densité électronique à x, se termine par une charge partielle positive δ+. Le plus négatif Δ-, le plus riche en électrons sera x et plus la carence électronique de H sera grande. Par conséquent, en fonction de l'élément X, une hydracence peut être plus ou moins polaire.
L'image montre également la structure des hydracides. H-X est une molécule linéaire, qui peut interagir avec une autre par l'une de ses extrémités. Plus il est polaire HX, ses molécules interagiront avec une plus grande force ou affinité. En conséquence, ses points d'ébullition ou de fusion augmenteront.
Cependant, les interactions H-X-H-X restent suffisamment faibles pour provoquer une hydrace solide. Par conséquent, dans des conditions de pression et de température ambiante, il y a des substances gazeuses; Sauf pour HF, qui s'évapore au-dessus de 20 ° C.
Parce que? Parce que HF est capable de former de forts ponts d'hydrogène. Tandis que d'autres hydraceides, dont les éléments non métalliques sont moins électronégatifs, peuvent à peine être en phase liquide en dessous de 0º C. HCl, par exemple, bouillir à -85º C.
Sont des substances acides hydratantes? La réponse est dans la charge partielle positive Δ + sur l'atome d'hydrogène. Si Δ + est très grand ou la liaison H-X très faible, alors Hx sera un acide fort, comme c'est le cas avec toutes les hydracènes halogènes, une fois que leurs halogénures respectifs sont dissous dans l'eau.
Caractéristiques de l'hydrat
Physique
Solutions transparentes
Visiblement que tous les hydracides sont des solutions transparentes, car les HX sont très solubles dans l'eau. Ils peuvent avoir des tons jaunâtres selon les concentrations de HX dissous.
Ils fument
Cela signifie qu'ils dégagent des vapeurs denses, corrosives et irritantes (certaines d'entre elles sont même des nauséabundos). En effet. De plus, Hx dans leurs formes anhydre est des composés gazeux.
Ce sont des conducteurs d'électricité
L'hydratie sont de bons conducteurs d'électricité. Bien que les HX soient des espèces gazeuses dans des conditions atmosphériques, lorsqu'elles se dissolvent dans l'eau, elles libèrent des ions (H+X-), qui permettent le passage du courant électrique.
Peut vous servir: processus thermodynamiquesSes points d'ébullition sont plus élevés que ceux de leurs formes anhyaires
C'est-à-dire que Hx (AC), qui dénote l'hydratie, bout à des températures supérieures à Hx (g). Par exemple, le chlorure d'hydrogène, HCl (G), bouil.
Parce que? Parce que les molécules gazeuses HX sont entourées d'eau. Parmi eux, deux types d'interactions peuvent se produire en même temps: les ponts Hx - H2Ou - Hx, ou solvération ionique, h3SOIT+(Ac) et x-(AC). Ce fait est directement lié aux caractéristiques chimiques de l'hydrat.
Produits chimiques
Les hydracides sont des solutions très acides, donc elles ont des protons acides H3SOIT+ Disponible pour réagir avec d'autres substances.
Où se pose3SOIT+? De l'atome d'hydrogène avec une charge partielle positive Δ +, qui se dissocie dans l'eau et finit par incorporer de manière covalente dans une molécule d'eau:
Hx (ac) + h2O (l) x-(AC) + H3SOIT+(AC)
Notez que l'équation correspond à une réaction qui établit un équilibre. Lorsque la formation de x-(AC) + H3SOIT+(AC) est thermodynamiquement très favorisé, HX libérera son proton d'eau à l'eau; Et puis ceci, avec H3SOIT+ Comme son nouveau "porteur", vous pouvez réagir avec un autre composé, même si ce dernier n'est pas une base forte.
Ce qui précède explique les caractéristiques acides de l'hydrat. Cela se produit pour tous les HX dissous dans l'eau; Mais certains génèrent plus de solutions acides que d'autres. Et c'est due a quoi? Les raisons peuvent être très compliquées. Tous les HX (AC) ne favorisent pas l'équilibre précédent à droite, c'est-à-dire vers x-(AC) + H3SOIT+(AC).
Acidité
Et l'exception est observée dans l'acide fluorhorique, HF (AC). Le fluor est très électronégatif, donc, raccourcisse la distance de la liaison H-X, la renforçant devant sa rupture par action de l'eau.
De même, le lien H-F a beaucoup mieux de chevauchement pour les raisons atomiques des radios. D'un autre côté, les liaisons H-Cl, H-BR ou H-I sont plus faibles et ont tendance à se dissocier complètement dans l'eau, au point de rompre avec l'équilibre soulevé au-dessus.
En effet. Par conséquent, la liaison H-X présente le chevauchement orbital le plus pauvre car X est plus grand, ce qui a à son tour une force acide lorsqu'elle est en contact avec l'eau.
De cette façon, l'ordre décroissant d'acidité des hydracides halogènes est le suivant: HF< HCl Dans ses formes anhyaires, HX (g), elles doivent être mentionnées comme dictées pour les halogénures d'hydrogène: l'ajout du suffixe -aurochs À la fin de leurs noms. Par exemple, le hi (g) se compose d'un halogénure (ou d'un hydrure) formé par l'hydrogène et l'iode, donc son nom est: yodaurochs d'hydrogène. Parce que généralement les non-métaux sont plus électronégatifs que l'hydrogène, il a un nombre d'oxydation de +1. Dans NAH, en revanche, l'hydrogène a un nombre d'oxydation de -1. Il s'agit d'une autre manière indirecte de différencier les hydrors moléculaires des halogénures halogènes ou d'hydrogène des autres composés. Une fois hx (g) entre le contact avec l'eau, il est représenté comme Hx (AC) puis a l'hydratie. Pour nommer l'hydratie, HX (AC), le suffixe devra être remplacé -aurochs de ses formes anhyaires par le suffixe -Eau. Et doit être mentionné comme les acides en premier. Ainsi, pour l'exemple précédent, le Hi (AC) est nommé comme: Yod AcidEau. Les hydraceides peuvent être formés par une simple dissolution de leurs halogénures d'hydrogène correspondants dans l'eau. Cela peut être représenté avec l'équation chimique suivante: Hx (g) => hx (ac) HX (g) est très soluble dans l'eau, il n'y a donc pas d'équilibre de solubilité, contrairement à sa dissociation ionique pour libérer les protons acides. Cependant, il existe une méthode synthétique qui est préférée car elle utilise comme sels ou minéraux de matières premières, les dissolvant à basse température avec des acides forts. Si la table du sel, NaCl, se dissout avec de l'acide sulfurique concentré, la réaction suivante se produit: NaCl (s) + h2Swin4(ac) => hcl (ac) + nahso4(AC) L'acide sulfurique donne l'un de ses protons acides au chlorure d'anion-, Le transformant ainsi en acide chlorhydrique. De ce mélange peut échapper au chlorure d'hydrogène, HCl (G), car il est très volatil, surtout si sa concentration dans l'eau est très élevée. L'autre sel produit est le sulfate d'acide de sodium, NAHSO4. Une autre façon de le produire est de remplacer l'acide sulfurique par de l'acide phosphorique concentré: NaCl (s) + h3Pote4(ac) => hcl (ac) + nah2Pote4(AC) Le H3Pote4 réagit de la même manière que H2Swin4, Produire de l'acide chlorhydrique et du phosphate de déase de sodium. Le NaCl est la source de l'anion Cl-, de sorte que pour synthétiser les autres hydracests, sels ou minéraux contenant F sont nécessaires-, BR-, Toi-, S2-, etc. Mais l'utilisation de H2Swin4 ou h3Pote4 Il dépendra de sa force oxydative. Le H2Swin4 C'est un agent oxydant très fort, au point qui oxyde même le BR- et moi- à ses formes moléculaires br2 et moi2; Le premier est un liquide rougeâtre, et le second un solide violet. Par conséquent, H3Pote4 représente l'alternative préférée dans une telle synthèse. Les hydracides sont en substance utilisés pour dissoudre différents types de matière. En effet, ce sont des acides forts, et avec modération, ils peuvent nettoyer n'importe quelle surface. Leurs protons acides sont ajoutés aux composés d'impuretés ou de saletés, les rendant solubles dans l'environnement aqueux et sont ensuite traînés par l'eau. Selon la nature chimique de ladite surface, une hydratie ou une autre peut être utilisée. Par exemple, l'acide fluorhorhorique ne peut pas être utilisé pour nettoyer le verre car il les dissoudrait dans l'acte. L'acide chlorhydrique est utilisé pour éliminer les taches sur les carreaux de piscine. Ils sont également capables de dissoudre les roches ou des échantillons solides, puis utilisés à des fins analytiques ou de production à petite ou grande échelle. Dans la chromatographie d'échange d'ions, l'acide chlorhydrique dilué est utilisé pour nettoyer la colonne d'ion restante. Certaines réactions nécessitent des solutions très acides pour les accélérer et réduire le temps qu'il a lieu. C'est là que les hydracides entrent. Un exemple de ceci est l'utilisation de l'acide iarhydrique dans la synthèse de l'acide acétique glaciaire. L'industrie pétrolière a également besoin de l'hydratation dans les processus de raffinerie. Les hydracides fournissent non seulement des protons acides, mais aussi leurs anions respectifs. Ces anions peuvent réagir avec un composé organique ou inorganique pour former un halogénure spécifique. De cette façon, les fluorures, les chlorures, l'iodure. Ces haluros peuvent avoir des applications très diverses. Par exemple, ils peuvent être utilisés pour synthétiser des polymères, tels que le téflon; ou intermédiaires, à partir desquels des atomes halogènes seront incorporés dans les structures moléculaires de certains médicaments. Supposons la molécule ch3Ch2Oh, l'éthanol, réagit avec HCL pour former du chlorure d'éthyle: Ch3Ch2Oh + hcl => ch3Ch2Cl + H2SOIT Chacune de ces réactions cache un mécanisme et de nombreux aspects qui sont pris en compte dans la synthèse organique. Il n'y a pas beaucoup d'exemples disponibles pour les hydracides, car le nombre de composés possibles est naturellement limité. Pour cette raison, certains hydracides supplémentaires sont répertoriés ci-dessous avec leur nomenclature respective (l'abréviation (AC)) est ignorée: Hydrataceide binaire dont les molécules H-F forment de forts ponts d'hydrogène, au point que dans l'eau, c'est un acide faible. Contrairement aux hydracides considérés jusque-là, il est polyiatomique, c'est-à-dire qu'il a plus de deux atomes, cependant, il continue d'être binaire car ils sont deux éléments: soufre et hydrogène. Ses molécules angulaires H-S-H ne forment pas de ponts d'hydrogène appréciables et peuvent être détectées par leur pourriture caractéristique des œufs pourris. L'un des acides les plus connus de la culture populaire. Il fait même partie de la composition du jus gastrique, présent dans l'estomac, et avec les enzymes digestives, ils dégradent les aliments. En tant qu'acide iarydrique, en phase gazeuse, il se compose de molécules linéaires H-Br, qui se dissocient sur les ions H+ (H3SOIT+) et br- Quand ils entrent dans l'eau. Bien que la Télurio ait un certain caractère métallique, son hydracence dégage des vapeurs désagréables et extrêmement toxiques, comme l'acide séléenhydrique. Ainsi que l'autre hydratie des traces2-, Donc son Valence est -2.Nomenclature des hydracides
Forme anhydre
En solution aqueuse
Comment sont l'hydrace?
Dissolution directe des halogénures d'hydrogène
Dissolution des sels non métalliques avec des acides
Utilisations de l'hydrat
Nettoyants et solvants
Catalyseurs acides
Réactifs pour la synthèse des composés organiques et inorganiques
Exemples d'hydracées
HF, acide fluorhorique
H2S, acide sulfhydrique
HCl, acide chlorhydrique
HBR, acide bromhydrique
H2Thé, acide télécréactif
Les références

