Forces de Londres
- 1453
- 204
- Mlle Ambre Dumont
 Les forces de Londres sont des interactions faibles intermoléculaires. Source: Riccardo Rovinetti, Wikimedia Commons
Les forces de Londres sont des interactions faibles intermoléculaires. Source: Riccardo Rovinetti, Wikimedia Commons Quelles sont les forces de Londres?
Le Forces de Londres, Les forces de dispersion de Londres ou les interactions induites par dipole sont le type le plus faible d'interactions intermoléculaires. Son nom est dû aux contributions du physicien théorique Fritz London (1900-1954) et de ses études dans le domaine de la physique quantique.
Les forces de Londres expliquent comment les molécules interagissent dont les structures et les atomes font la formation d'un dipôle permanent; Autrement dit, s'applique fondamentalement aux molécules ou atomes apolaires isolés de gaz nobles.
Contrairement aux autres forces de van der Waals, cela nécessite des distances extrêmement courtes.
Caractéristiques des forces de Londres
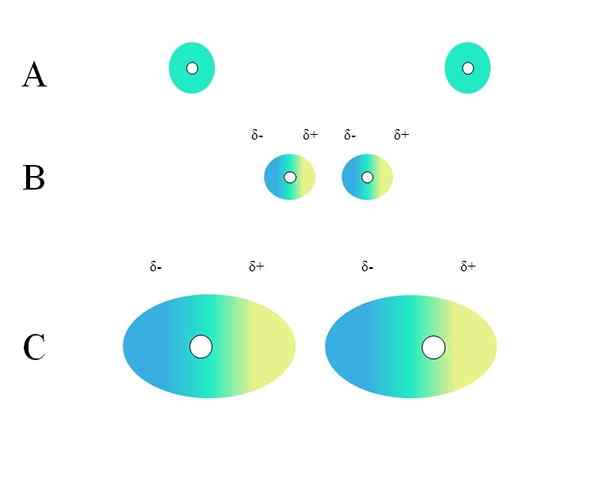 Distribution des charges homogènes. Source: Gabriel Bolívar
Distribution des charges homogènes. Source: Gabriel Bolívar Quelles caractéristiques une molécule devrait avoir pour qu'elle puisse interagir à travers les forces de Londres? La réponse est que n'importe qui pourrait le faire, mais lorsqu'il y a un moment dipolaire permanent, les interactions de type dipol-dipolo prédominent plutôt que la dispersion, contribuant très peu à la nature physique des substances.
Dans les structures où il n'y a pas d'atomes très électronégatifs ou dont la distribution de charge électrostatique est homogène, il n'y a pas de fin ou de région qui peut être considérée comme riche (Δ-) ou pauvre (Δ +) dans les électrons.
Dans ces cas, d'autres types de forces doivent intervenir, ou autrement, ces composés ne pouvaient exister que dans une phase gazeuse, indépendamment des conditions de pression ou de température qui fonctionnent sur eux.
Distribution de charge homogène
Deux atomes isolés, comme le néon ou l'argon, ont une distribution de charge homogène. Cela peut être vu dans une image supérieure. Les cercles blancs au centre représentent les noyaux, pour les atomes, ou le squelette moléculaire, pour les molécules. Cette distribution de charge peut être considérée comme un nuage d'électrons verts.
Pourquoi les gaz nobles rencontrent-ils cette homogénéité? Parce qu'ils ont leur couche électronique complètement pleine, donc leurs électrons doivent théoriquement ressentir également l'attraction de charge du noyau dans toutes les orbitales.
D'un autre côté, pour d'autres gaz tels que l'oxygène atomique (O), sa couche est incomplète (qui est observée dans sa configuration électronique) et le force à former la molécule diatomique ou2 Pour compenser cette carence.
Les cercles verts de A peuvent également être des molécules, petites ou grandes. Son orbite électrons nuage autour de tous. Autour de ces atomes, le nuage se concentrera et sera plus négatif, tandis que d'autres atomes auront une carence électronique.
Peut vous servir: liaison covalente non polaireCependant, ce nuage n'est pas statique mais dynamique, donc à un moment donné, des régions brèves Δ- et Δ + se formeront, et un phénomène appelé se produira Polarisation.
Polarisabilité
Dans le nuage vert indique une distribution de charge négative homogène. Cependant, la force d'attraction positive exercée par le noyau peut aller sur les électrons. Cela provoque une déformation des nuages créant ainsi des régions Δ-, bleu et Δ +, jaune.
Ce moment dipolaire soudain dans l'atome ou la molécule peut déformer un nuage électronique adjacent; En d'autres termes, il induit un dipôle soudain sur son voisin (B, image supérieure).
En effet+.
Notez comment les pôles positifs sont alignés sur les négatifs, tout comme les molécules avec des moments dipolaires permanents. Plus le nuage électronique est volumineux, plus le noyau le gardera homogène dans l'espace; Et en outre, ce sera la déformation de celui-ci, comme on peut le voir dans c.
Par conséquent, il est peu probable que les petits atomes et molécules soient plus polarisés par toute particule de leur environnement. Un exemple de cette situation est illustré par la petite molécule d'hydrogène, H2.
Condenser, voire plus, cristalliser, a besoin de pressions exorbitantes pour forcer ses molécules à interagir physiquement.
Est inversement proportionnel à la distance
Bien que des dipôles instantanés soient formés qui induisent les autres autour d'eux, ils ne sont pas suffisants pour garder les atomes ou les molécules ensemble.
En b il y a une distance d qui sépare les deux nuages et leurs deux noyaux. Pour que les deux dipôles puissent rester pendant un temps considéré, cette distance d Ça doit être très petit.
Cette condition doit être remplie, une caractéristique essentielle des forces de Londres (rappelez-vous la fermeture du velcro), de sorte qu'un effet notoire sur les propriétés physiques de la question est fournie.
Une fois d être petit, le noyau de la gauche en B commencera à attirer la région bleue Δ- de l'atome ou de la molécule voisine. Cela déformera encore le nuage, comme on peut le voir dans C (le noyau n'est plus au centre mais à droite).
Peut vous servir: alcènesEnsuite, il y a un point où les deux nuages se touchent et "Bounce", mais à une lenteur suffisante pour les avoir avec un temps.
Par conséquent, les forces de Londres sont inversement proportionnelles à la distance d. En fait, le facteur est égal à d7, Ainsi, une variation minimale de la distance entre les atomes ou les molécules s'affaiblira ou renforcera la dispersion de Londres.
Il est directement proportionnel à la masse moléculaire
Comment augmenter la taille des nuages afin qu'ils soient plus facilement polarisés? Ajout d'électrons, et pour cela, le noyau doit avoir plus de protons et de neutrons, augmentant ainsi la masse atomique; ou ajoutant des atomes au squelette de la molécule, qui à son tour augmenterait sa masse moléculaire.
De cette façon, les noyaux ou le squelette moléculaire seraient moins susceptibles de garder le nuage électronique tout leur temps. Par conséquent, plus les cercles verts considérés dans A, B et C, plus ils seront polarisables et plus seront également leurs interactions par les forces de Londres.
Cet effet est clairement observé entre B et C, et il pourrait l'être encore plus si les cercles étaient de plus grand diamètre. Ce raisonnement est essentiel pour expliquer les propriétés physiques de nombreux composés en fonction de leurs masses moléculaires.
Exemples de forces de Londres
 Exemple naturel des forces de Londres: les jambes des Gecos
Exemple naturel des forces de Londres: les jambes des Gecos Dans la nature
Dans la vie quotidienne, il existe d'innombrables exemples de forces de dispersion de Londres sans avoir besoin de s'aventurer, en premier lieu, le monde microscopique.
L'un des exemples les plus courants et les plus surprenants se trouve dans les jambes des reptiles connus sous le nom de GECOS (image supérieure) et dans de nombreux insectes (également dans Spiderman).
Dans leurs jambes, ils ont des coussinets dont des milliers de petits filaments se démarquent. Dans l'image, vous pouvez voir un geco posant sur la pente d'un rocher. Pour y parvenir, il utilise les forces intermoléculaires entre la roche et les filaments de leurs jambes.
Chacun de ces filaments interagit faiblement avec la surface à travers laquelle le petit reptile. Les GECOS sont également capables de gravir des surfaces lisses et parfaites comme celles des cristaux.
Il peut vous servir: nitrite de potassium (KNO2): structure, propriétés et utilisationsSe ferme
Les alcanes sont des hydrocarbures saturés qui interagissent également par les forces de Londres. Ses structures moléculaires se composent simplement de carbones et d'hydrogènes unis par des liaisons simples. Étant donné que la différence d'électronégativités entre C et H est très petite, ce sont des composés apolaires.
Ainsi, méthane, cho4, Le plus petit hydrocarbure de tous, bouillonne à -161.7e C. Comme C et H sont ajoutés au squelette, d'autres alcanes sont obtenus avec des masses moléculaires plus élevées.
De cette façon, l'éthane survient (-88.6e c), butane (-0.5e c) et l'octane (125.7e c). Notez comment leurs points d'ébullition augmentent à mesure que les alcanes deviennent plus lourds.
En effet.
L'octane, bien qu'il s'agit d'un composé apolaire, a un point d'ébullition supérieur à celui de l'eau.
Halogènes et gaz
Les forces de Londres sont également présentes dans de nombreuses substances gazeuses. Par exemple, n molécules2, H2, CO2, F2, CL2 Et tous les gaz nobles interagissent à travers ces forces, car ils ont une distribution électrostatique homogène, qui peut souffrir d'un instantané et donner lieu à des polarisations.
Les gaz nobles sont il (hélium), néon (néon), ar (argon), kr (kripton), xe (xénon) et rn (radon). De gauche à droite, leurs points d'ébullition augmentent avec l'augmentation des masses atomiques: -269, -246, -186, -152, -108 et -62 ºC.
Les halogènes interagissent également à travers ces forces. Le fluor est un gaz à température ambiante, tout comme le chlore. Le brome, avec une plus grande masse atomique, est dans des conditions normales comme un liquide rougeâtre, et de l'iode, pour terminer, forme un solide violet qui sublimate rapidement car il est plus lourd que les autres halogènes.
Les références
- Whitten, Davis, Peck & Stanley. Chimie. (8e Ed.). Cengage Learning, p 452-455.
- Angeles Méndez. (22 mai 2012). Forces de dispersion (de Londres). Récupéré de: chimie.Laguia2000.com
- Forces de dispersion de Londres. Récupéré de: Chem.Purger.Édu
- Helmestine, Anne Marie, Ph.D. (22 juin 2018). 3 types de forces intermoléculaires. Récupéré de: Thoughtco.com
- Ryan Illagan et Gary L Bertrand. Interactions de dispersion de Londres. Tiré de: Chem.Bibliothèque.org
- ChemPages Norims. Forces de Londres. Récupéré de: Chem.WISC.Édu
- Kamereon. (22 mai 2013). Salamanqueas: Le Geco et les forces de van der Waals. Récupéré de: Almabiologica.com

