Structure des glycoprotéines, fonctions, classes et exemples
- 5186
- 1411
- Eva Henry
Le glycoprotéines soit Glucoprotéines Ce sont des protéines transmarket qui font partie de la grande famille de glyconjugue membranaire et sont présents chez les animaux, les plantes et les micro-organismes tels que les bactéries, les levures et les arches.
Ils ont été définis pour la première fois en 1908 par le comité de nomenclature des protéines de l'American Biochemical Society et sont le résultat de l'union glycosidique d'une protéine avec une portion de glucides appelée Glucano.
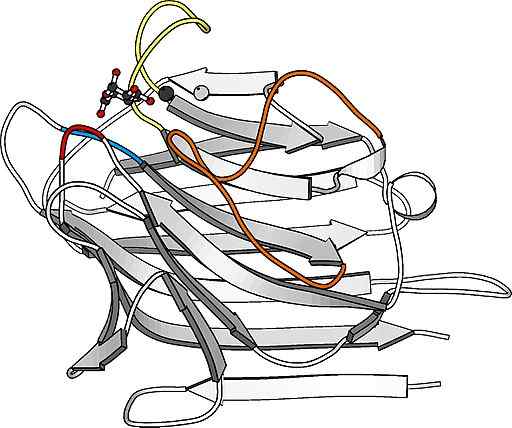
 Structure du monomère de lectina
Structure du monomère de lectina Ce sont des protéines particulièrement abondantes à la surface de la membrane plasmique de nombreuses cellules et constituent une partie importante de la couche de glucides qui les couvre et qui, dans de nombreux cas, est appelée glucocálix.
Les protéines précurseurs des glycoprotéines sont modifiées de manière covalente dans le réticulum endoplasmique et le complexe de Golgi de nombreux eucaryotes après leur traduction, bien qu'il existe également des cas de glycosylation dans le cytosol, mais ils sont moins communs et se produisent avec un seul type de sucre.
La glycosylation des protéines a souvent des effets fonctionnels importants dans son activité, car il peut participer au pliage et, par conséquent, à l'établissement de sa structure tertiaire.
Les gluans ont plusieurs fonctions biologiquement importantes pour la cellule, car elles peuvent conférer une spécificité aux cellules et participer à des processus de signalisation intra et intercellulaires, car ce sont des ligands pour les récepteurs endogènes et exogènes.
Les glycoprotéines, ainsi que le reste des glyconjugados, sont si importantes qu'une cellule consacre jusqu'à 1% de son génome en machines de glycosylation et, chez l'homme, plus de 70% des protéines sont modifiées par glycosilation.
[TOC]
Structure
La structure des glycoprotéines est étudiée en fonction de leur séquence d'acides aminés, des sites de glycosylation au sein de la séquence et des structures des parties du glucane qui sont jointes à ces endroits.
Les chaînes d'oligosaccharides qui se lient par la glycosylation à ces protéines sont généralement très diverses, mais elles sont courtes, car elles ne dépassent pas 15 déchets de sucre. Certaines protéines ont une seule chaîne oligosaccharide, mais d'autres peuvent en avoir plus d'un et celles-ci peuvent être ramifiées.
L'union entre les oligosaccharides et les protéines se produit à travers le carbone glucidique anomérique et le groupe hydroxyle (-OH) d'un résidu sérine ou treonine, dans le cas de la SOIT-glycosylation, ou par l'azote amida de résidu d'asparagine, dans le cas du N-glycosylation.
Les glucides unis peuvent représenter jusqu'à 70% du poids moléculaire d'une glycoprotéine et les caractéristiques de la partie glucidique (taille et charge, par exemple) peuvent protéger certaines protéines contre la protéolyse enzymatique.
Peut vous servir: gélose de la farine de maïs: fondation, préparation et utilisationLa même protéine peut avoir, dans différents tissus, différents schémas de glycosylation qui en font une glycoprotéine différente, car la structure complète comprend non seulement les déchets d'acides aminés et leurs arrangements spatiaux, mais aussi aux oligosaccharides attachés à ceux-ci.
Parmi les résidus de sucre qui sont à plusieurs reprises dans les glycoprotéines, il y a: D-galactose, D-Kinesea, D-glucose, L-fucose, D-xilosa, L-arabinofuranosa, N-acétyl-d-glycosamine, N-acétyl -D-Galactosamine , quelques acides sialiques et modifications de tous ces.
Les fonctions
De construction
Du point de vue structurel, les glycoprotéines fournissent des chaînes de glucides qui participent à la protection et à la lubrification des cellules, car celles-ci sont capables d'hydrater et de former une substance visqueuse qui résiste aux agressions mécaniques et chimiques.
Dans les bactéries et les arches, il existe également des glycoprotéines et ce sont des composants importants de la couche S, qui est la couche la plus externe de la couverture cellulaire.
De plus, ils sont également trouvés comme des constituants de protéines flagelines, qui font partie des filaments flagellaires qu'ils utilisent comme organes locomoteurs.
Les plantes ont également des glycoprotéines structurelles qui sont caractérisées par des modèles de glycosylation complexes et peuvent être trouvées dans le cadre de la structure de la paroi cellulaire ou dans la matrice extracellulaire.
Reconnaissance cellulaire
Les glycoprotéines exercent des fonctions transcendantales telles que les sites de reconnaissance entre les cellules, car de nombreux récepteurs de surface cellulaire sont capables de reconnaître des séquences d'oligosaccharides spécifiques.
Exemple de reconnaissance intercellulaires qui se produisent à travers les chaînes d'oligosaccharides à la surface cellulaire est le cas de reconnaissance entre l'ovule et le sperme, nécessaire pour que le phénomène de fertilisation soit donné dans les organismes multicellulaires avec reproduction sexuelle avec reproduction sexuelle.
Le groupe sanguin chez l'homme est déterminé par l'identité des sucres attachés à des glycoprotéines qui les spécifient. Les anticorps et de nombreuses hormones sont également des glycoprotéines et leurs fonctions sont essentielles pour la signalisation corporelle et la défense.
Adhérence cellulaire
Les lymphocytes T du système immunitaire des mammifères ont une glycoprotéine avec des domaines d'adhésion appelés CD2, qui est un composant clé pour la stimulation immunitaire depuis l'union entre les lymphocytes et l'antigène présentant les cellules par son récepteur, la glycoprotéine CD58.
Certains virus qui ont des fonctions pathogènes importantes pour de nombreux mammifères, et parmi lesquelles des êtres humains ont des glycoprotéines de surface qui fonctionnent dans les processus d'adhésion de la particule virale aux cellules qui parasitent.
Peut vous servir: organismes autotrophesC'est le cas de la protéine gp120 du virus humain de l'immunodéficience ou du VIH acquise, qui interagit avec une protéine superficielle de cellules humaines connues sous le nom de GP41 et collabore avec l'entrée du virus de la cellule.
De la même manière, de nombreuses protéines glycosylées participent à d'importants processus d'adhésion cellulaire qui se déroulent dans la vie ordinaire des cellules présentes dans de nombreux tissus d'organismes multicellulaires.
Les glycoprotéines comme cibles thérapeutiques
Ces complexes de protéines gluant sont les blancs préférés par de nombreux agents pathogènes tels que les parasites et les virus, et de nombreuses glycoprotéines avec des modèles de glycosylation aberrants ont des fonctions déterminantes dans les maladies auto-immunes et les cancers.
Pour ces raisons, divers chercheurs ont donné la tâche d'élever ces protéines comme cibles thérapeutiques possibles et pour la conception de méthodes de diagnostic, de thérapies de nouvelle génération et même pour la conception de vaccins.
Des classes
La classification des glycoprotéines est basée principalement sur la nature du lien glycosidique qui unit les portions des protéines et des glucides et sur les caractéristiques des Glucans unis.
Selon des déchets sucrés, des glycoprotéines peuvent être obtenues avec des monosaccharides, disaccharides, oligosaccharides, polysaccharides et dérivés de ces. Certains auteurs considèrent une classification des glycoprotéines dans:
- Les protéoglycanes, qui sont une sous-classe au sein du groupe de glycoprotéines qu'il contient, dans la partie glucidique, les polysaccharides composés principalement d'aminoazúces (glucosaminoglycanes).
- Les glycopeptides, qui sont des molécules composées de glucides attachés aux oligopeptides formés par des acides aminés dans leurs conformations L et / ou D.
- Les acides aminés gluco, qui sont des acides aminés attachés à un saccharide à travers tout type de liaison covalente.
- Les acides aminés glycosil, qui sont des acides aminés attachés à une partie saccharide à travers des liaisons O-, N- ou S-glycycosidiques.
Dans la nomenclature de ces protéines ainsi uni aux glucides, les préfixes O-, N- et S- pour spécifier à travers les liaisons des sucres sont joints à la chaîne polypeptidique.
Exemples
- La glyphorine A est l'une des glycoprotéines les mieux étudiées: il s'agit d'une protéine intégrale de la membrane érythrocytaire (cellules ou globules rouges du sang) et a 15 chaînes d'oligosaccharides liés de manière covalente au déchet d'acides aminés de la région N-terminale par le biais de OF de OF OF OF OF OF1111 liens SOIT-glycosidique et une chaîne unie par un lien N-glycosidique.
- La plupart des protéines sanguines sont des glycoprotéines et ce groupe comprend des immunoglobulines et de nombreuses hormones.
Peut vous servir: importance du carbone dans les êtres vivants- Lactoalbumine, une protéine présente dans le lait est la glycosilada, ainsi que de nombreuses protéines pancréatiques et lyosomales.
- Les lectines sont des protéines syndicales glucidiques et pour elles, ils ont de multiples fonctions en reconnaissance.
- Il est également nécessaire de mettre en évidence de nombreuses hormones animales qui sont des glycoprotéines; Parmi ceux-ci, il peut mentionner la lutropine (LH), la folitropine (FSH) et la thyrotropine (TSH), qui sont synthétisées dans la glande pituitaire antérieure, et la gonadotrophine chorionique qui est produite dans le placenta des humains, des primates et des chevaux.
Ces hormones ont des fonctions de reproduction puisque la LH stimule la stéroïdogenèse dans les ovaires et les cellules testiculaires de Leydig.
- Le collagène, abondante protéine présente la priorité dans les tissus conjonctifs animaux, représente une énorme famille de glycoprotéines composées de plus de 15 types de protéines qui, bien qu'elles aient de nombreuses caractéristiques en commun, sont très différents.
Ces protéines contiennent des portions «non collagènes», dont certaines sont formées par glucides.
- Les extensines sont des protéines végétales qui se composent d'un réseau de glycoprotéine insoluble qui sont riches en résidus d'hydroxiproline et de sérine. Ils se trouvent sur la paroi des cellules végétales et pensent qu'ils exercent des fonctions en défense contre différents types de stress et d'agents pathogènes.
- Les plantes ont également des protéines de lectine et un exemple spécial d'entre eux sont des lectines de pommes de terre, qui ont apparemment la capacité de rassembler les cellules sanguines telles que les érythrocytes.
- Enfin, mais notamment peut être nommé mucinas, qui sont des glycoprotéines sécrétées dans des muqueuses et font partie de la salive chez les animaux, remplissant des fonctions de lubrification et de signalisation, principalement.
Les références
- Montreuil, J., Vliegenthart, J., & Schachter, H. (Année mille neuf cents quatre-vingts-quinze). Glycoprotéines. (POUR. Neuberger & l. Deenen, éd.). Elsevier.
- Nelson, D. L., & Cox, M. M. (2009). Principes de lehninger de la biochimie. Éditions Omega (5e Ed.). https: // doi.org / 10.1007 / S13398-014-0173-7.2
- Struwe, w., & Cosgrave, et. (2011). Protéomique fonctionnelle et structurelle des glycoprotéines. (R. Owens & J. Nettleship, eds.). Londres: Springer.
- Voet, D., & Voet, J. (2006). Biochimie (3e érigé.). Pan -American Medical Editorial.
- Wittman, V. (2007). Glycopeptides et glycoprotéines. Synthèse, structure et application. (V. Balzani, J.-M. Lehn, un. De meijere, s. Law, K. Houk, s. Schreiber, J. Thiem, éd.). Leipzig: Springer Science + Business Media, LLC.
- « Le décalage technologique et éducatif en Afrique et en Amérique latine
- Structure des acides gras, types, fonctions, biosynthèse »

