Galvanoplastie

- 4203
- 1158
- Raphaël Meyer
Nous expliquons en quoi consiste la galvanoplastie, également appelée électrodéposition, comment est son processus, les exemples pratiques et ses applications.
 Galvanoplastie d'une cuillère
Galvanoplastie d'une cuillère Qu'est-ce que la galvanoplastie?
La galvanoplastie ou l'électrodéposition est une technique électrochimique qui consiste, comme son nom l'indique, pour déposer des couches de métaux sur les objets récepteurs; C'est-à-dire les couvrant à partir d'un couvercle en métal, dont l'épaisseur varie entre 5-20 μm.
Cette technique est également connue sous le nom d'électrochapado ou de plaque électrolytique, comme un milieu électrolytique composé d'ions métal. Par conséquent, si nous voulons un plateau en cuivre (cuivre), nous aurons besoin de sels solubles en cuivre, comme le sulfate de cuivre, dissous dans l'eau.
Le raisonnement précédent s'applique à tout autre métal: un plaqué électrolytique en or nécessitera des sels d'or, généralement des cyanures d'or, qui peuvent devenir très toxiques. Ainsi, certains objets, tels que des ustensiles alimentaires, peuvent être recouverts d'or pour attribuer une plus grande valeur et noblesse.
Mais la galvanoplastie va au-delà de l'esthétique: ils sont conférés. Il permet également d'économiser des ressources naturelles, car il n'est pas nécessaire de dépenser de grandes quantités de métal pour les revêtements.
Processus de galvanoplastie
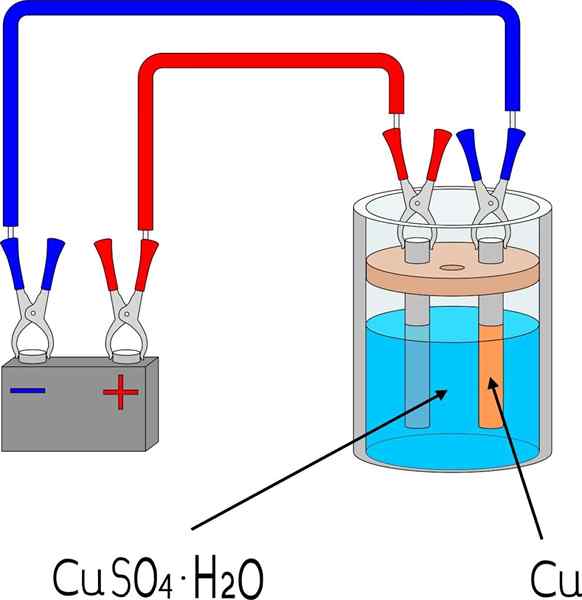 Électrodéposition en cuivre dans une salle de bain en cuivre sulfate
Électrodéposition en cuivre dans une salle de bain en cuivre sulfate Articles
Pour électrodéposer un métal sur une surface, certains éléments de base sont nécessaires, dont les dimensions et le mode varieront en fonction du lot d'objets à couvert.
Dans l'image supérieure, par exemple, une petite électrode en cuivre à l'échelle est représentée, reproductible dans n'importe quel laboratoire ou espace.
Médium électrolytique
Tout d'abord, un milieu électrolyte du métal en électrodéposition est nécessaire. Sel de sulfate de cuivre, Cuo4, Il est très soluble dans l'eau, donc il apporte des ions Cu2+ qui sera ensuite réduit aux atomes Cu0. Ces atomes sont ceux qui seront assemblés sur la surface de réception pour donner naissance à des cristaux métalliques.
Le milieu électrolytique est indispensable pour que le circuit fonctionne et que les charges ioniques peuvent se déplacer ou se mobiliser vers la région où l'électrodéposition se produit.
Électrodes
Les électrodes sont les surfaces sur lesquelles l'électrodéposition se déroule à partir de sa base chimique. En termes simples, il y a deux électrodes: la cathode, où le métal est électrodepos; Et l'anode, où une réaction chimique a lieu qui donne des électrons aux ions métalliques qui couvriront la cathode.
Il peut vous servir: uréthane: structure, propriétés, obtention, utilisationsC'est-à-dire que la cathode devient la pièce souhaitée. Pendant ce temps, l'anode est toute surface sur laquelle une espèce oxyde et donne ses électrons à la cathode. Plusieurs fois, l'anode est faite du même métal qui est dissous dans l'environnement électrolytique. S'il y a du cuivre ionique au milieu, dans ce cas, l'anode sera en cuivre métallique.
Circuit externe
Le circuit externe est une batterie qui fournit les électrons initiaux qui favorisent l'électrodéposition. Sa présence signifie que la réaction n'est pas spontanée: l'électricité est nécessaire pour générer un changement chimique, qui est la réduction des ions métalliques dissous.
Nettoyage d'électrode
La pièce à couvert doit être complètement propre. Sinon, le plateau ou le revêtement sera défectueux.
Pour ce faire, vous devez vous assurer que sa surface est entièrement hydrophile, c'est-à-dire qu'elle n'a pas de graisse ou de saleté. Une façon de s'assurer que cela, après le lavage chimique, est de mouiller la pièce avec de l'eau, et si la formation de gouttes d'eau ou une goutte de liquide non uniforme est observée, cela signifie que l'électrode n'est pas encore propre.
Réactions et signification des électrons
La galvanoplastie est une réaction redox. Par conséquent: une espèce doit être réduite, tandis que l'autre oxydée, ou vice versa. Dans le cuivre, nous avons une anode en cuivre et une cathode en métal (fer, zinc, étain, etc.).
Lorsque nous allumons la batterie, ils couleront les électrons vers la cathode, qui commence à se charger négativement.
La charge négative de la cathode attire les cations Cu2+ de l'environnement électrolytique, se déroulant la réduction:
Cu2+(AC) + 2E- → Cu (s)
Il peut vous servir: réaction de MaillardLa batterie doit récupérer les électrons donnés, et les ions CU doivent également être récupérés2+ réduit pour maintenir la neutralité de l'environnement électrolytique. C'est à ce moment que l'anode est disponible en fonction: les atomes de cuivre oxydent:
Cu (s) → Cu2+(AC) + 2E-
Et les électrons libérés sont dirigés vers la batterie, qui à son tour les mobilise vers la cathode pour continuer l'électrodéposition.
L'anode gagne une charge positive, ce qui attire les ions SO42- du milieu électrolytique (voir l'image une fois de plus).
C'est-à-dire les réactions qui se produisent est la réduction et l'oxydation du cuivre, le métal qui est des électrodes:
Cu2+(AC) + 2E- → Cu (s)
Cu (s) → Cu2+(AC) + 2E-
L'anode, de cuivre, perd la pâte tandis que la cathode, d'un autre métal, est recouverte d'une fine couche cuivrée.
Exemples de galvanoplastie
Argent
Les métaux peuvent être "électroplatés", qui les couvrent électrolytiquement à partir d'une couche d'argent. Ceci est particulièrement bénéfique dans les composants électroniques qui doivent conduire l'électricité. L'argent peut être électrodeposita sur l'acier, le cuivre, le nickel et d'autres métaux.
En conserve
Le Tinner est l'électrodéposition de l'étain. Il est très utile dans la production de boîtes de fer, qui sont recouvertes d'étain pour les rendre résistantes à la corrosion, et donc ne pas endommager les aliments ou les produits qui stockent.
Latin ou bronzage
Bien que un peu plus élaboré, le laiton et le bronze peuvent également être des électrodes sur certains métaux pour améliorer leur apparence.
Zincado
La galvanoplastie du zinc ou du zinc (sans confusion avec la galvanisée thermique) est principalement utilisée pour accorder une résistance au fer à la corrosion et des surfaces plus brillantes et plus attrayantes. Ainsi, sa fonction est esthétique et en même temps fonctionnelle, et se trouve dans des parties du corps telles que les roues.
Plastiques métalliques
Les plastiques, précédemment traités pour avoir une surface conductrice, peuvent également être recouverts de métal, ce qui est comme s'ils étaient adhérés à une feuille de papier d'aluminium.
Peut vous servir: Flash KitasatoApplications de galvanoplastie
La galvanoplastie ou les applications d'électrodéposition peuvent être divisées en fonctions ou esthétiques.
Fonctionnel
 Un mince électrodepos d'or dans les téléspectateurs des cas d'astronautes leur permet de protéger leurs yeux de la lumière du soleil
Un mince électrodepos d'or dans les téléspectateurs des cas d'astronautes leur permet de protéger leurs yeux de la lumière du soleil Enduire une pièce ou un objet, c'est fournir à sa surface des propriétés qui lui sont à elle seule. Par exemple, l'électro-position en cuivre ou en or fait les pièces qu'ils ont, il est donc idéal dans les circuits électroniques pour profiter des propriétés de ces métaux, sans avoir besoin de dépenser des tonnes d'or sur la fabrication de pièces entières et solides.
L'or, en revanche, protège les surfaces de chaleur et de rayonnement. C'est pour cette raison qu'il est largement utilisé dans les satellites et dans les casques des astronautes, car il reflète la lumière du soleil ainsi la préversation de leurs yeux, ou rapidement chaud.
Les aciers chromés ou nickés sont très résistants à la corrosion grâce à ces couches métalliques. C'est pourquoi la galvanoplastie est utilisée dans l'industrie pour protéger les métaux sensibles à la corrod.
Esthétique
Les placages métalliques brillent. Le zinc, le nickel et le chrome sont très utilisés à cet effet. De plus, l'or et l'argent sont des électrodes dans les anneaux, les chaînes, les bracelets, les tours, les pentes, etc., Et donc sa galvanoplastie trouve de nombreuses applications dans les magasins de bijoux et les ornementations, pour améliorer l'image et le prestige de ces vêtements.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2021). Électroplaste. Récupéré de: dans.Wikipédia.org
- Chris Woodford. (28 juillet 2020). Comment fonctionne l'électroples. Récupéré de: ExplintHatStuff.com
- Rob Snyder. (s.F.). Électrodéposition à l'échelle nanométrique. Institut d'éducation STEM. [PDF]. Récupéré de: à l'échelle nanométrique.un L.Édu
- Elsevier B.V. (2021). Électrodéposition. ScienceDirect. Récupéré de: ScienceDirect.com
- Vaishali Mittal. (10 décembre 2020). Électroplaste. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Singh Davneet. (9 juin 2020). Différents types d'électropling. Récupéré de: Teachoo.com
- Helmestine, Anne Marie, Ph.D. (26 août 2020). Qu'est-ce que l'électroples et comment ça marche? Récupéré de: Thoughtco.com

