Structure fulminate de mercure, propriétés, obtention, utilisations
- 1379
- 322
- Adrien Remy
Il Mercure fulminate Il s'agit d'un composé inorganique formé par les éléments de mercure (Hg), de carbone (C), d'azote (N) et d'oxygène (O) (O). Sa formule chimique est Hg (CNO)2. Il ne doit pas être confondu avec Mercury Cyanato, car bien que les deux composés aient les mêmes éléments, dans ce dernier, les atomes se lient différemment.
Il a été découvert par le chimiste anglais Edward Howard en 1800. Cependant, près de 200 ans avant d'avoir été accidentellement synthétisé par l'alchimiste allemand Johannes Kunckel, qui, pour l'explosion, ne l'a pas isolé, mais a laissé des archives écrites des ingrédients utilisés.
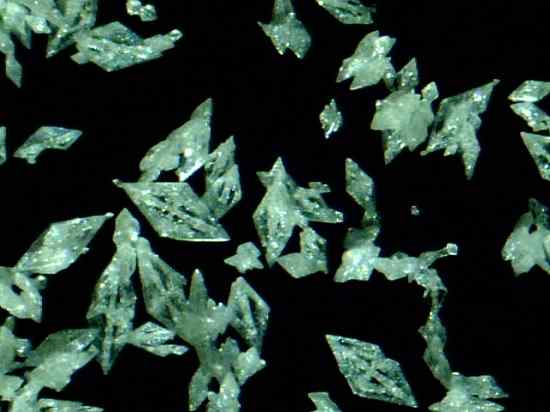
 Mercury fulminat cristaux HG (CNO)2. Daniel Grohmann / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Mercury fulminat cristaux HG (CNO)2. Daniel Grohmann / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. C'est un explosif primaire, il est donc utilisé dans les capsules de percussion ou de dynamitage pour promouvoir l'explosion d'autres substances. Bien que sa préparation et sa conservation soient extrêmement dangereuses, elle a été largement utilisée au XIXe siècle comme détonateur dans les armes de guerre et de chasse.
Il est actuellement utilisé pour la détonation de puissantes charges de dynamite dans la construction de tunnels et de routes et d'exploitation.
C'est clairement un composé extrêmement dangereux qui ne peut être manipulé que par des personnes ayant une connaissance approfondie de la façon de gérer les explosifs.
[TOC]
Structure
Le HG (CNO)2 C'est un sel d'acide fulminique hCNO. Contient du mercure dans l'oxydation +2 et deux unités de fulmination CNO-.
Selon une étude des rayons X menée en 2007 en Allemagne (rapportée en anglais en 2008), les molécules fulminantes de mercure ont la structure onc-hg-cnO, où il est observé que le mercure est directement lié aux atomes de carbone.
L'union C-HG-C est linéaire; Forme un angle de 180 ° et le groupe Fulminat (CNO) a une courte liaison en nitrogen et une liaison d'azote-oxygène plus longue.
La longueur de la liaison C-N est de 1,14-1.17 Å (Angstroms), ce qui correspond à un triple liaison faible. La liaison N-O est de 1,20-1.25 Å qui indique une double liaison faible. Un angstrom (Å) est une mesure de longueur et est la partie à dix melon d'un mètre.
Il peut vous servir: méthodes de séparation des mélanges homogènes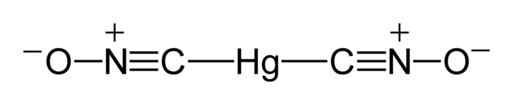 Structure de Lewis de Mercury Fulminat. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons.
Structure de Lewis de Mercury Fulminat. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons. À l'état solide, bien que l'Union C-HG-C soit linéaire et que le groupe CNO soit également, l'union N-C-HG s'écarte de la linéarité en 11 °, c'est-à-dire qu'elle a un angle de 169 °.
 Molécule Hg (CNO)2 À l'état solide. Gris = mercure; Noir = carbone; bleu = azote; Rouge = oxygène. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons.
Molécule Hg (CNO)2 À l'état solide. Gris = mercure; Noir = carbone; bleu = azote; Rouge = oxygène. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons. Cependant, selon l'étude susmentionnée, à l'état gazeux, la molécule complète est totalement linéaire.
Nomenclature
- Mercure fulminate
- Mercurique fulminate
- Mercure diffume
- Mercure bisfulate
- Sel de mercure d'acide fulminique
- Mercure fulminant
- Mercure explosif
Propriétés
État physique
Solide blanc à orange.
 HG (CNO)2 masgulin. Daniel Grohmann / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
HG (CNO)2 masgulin. Daniel Grohmann / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Poids moléculaire
284,63 g / mol
Point de fusion
Il ne fait pas fondre. Être chauffé à des exploits de plus de 100 ° C.
Densité
4,42 g / cm3
Solubilité
Légèrement soluble dans l'eau. Soluble dans l'éthanol (c2H5OH) et l'hydroxyde d'ammonium (NH4OH).
Propriétés chimiques
C'est un composé très explosif et très sensible aux coups, aux impacts ou à la friction. Vous pouvez facilement faire exploser avec des étincelles et des flammes. Lorsqu'il se décompose pour les gaz de mercure de forme (Hg), le monoxyde de carbone (CO) et l'azote (n2).
Avec de l'acide sulfurique (h2Swin4) Le concentré se produit également une détonation violente. L'acide chlorhydrique le dissout partiellement et le chlorure mercurique se produit.
Selon une étude menée en 1981, si elle subit un réchauffement contrôlé et très lent, sous une atmosphère d'argon inerte, lorsqu'il atteint 120 ° C, une décomposition non explassive se produit et que les gaz mercuriques solides et les gaz mercuriques et les gaz de mercure et les gaz oxygènes sont formés.
C'est un composé qui a été étudié par de rares moments pour son danger et de telles opportunités d'étude ont été très éloignées les unes des autres dans le temps. Vous devez travailler dans le noir pour éviter les explosions. Ses échantillons doivent être maintenus sous l'eau et sans lumière.
 HG solide (CNO)2 Garder sous l'eau. Daniel Grohmann / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
HG solide (CNO)2 Garder sous l'eau. Daniel Grohmann / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Obtention
Après sa découverte, il y a eu commercialement les réactions entre l'éthanol (CHO3Ch2Oh), mercure (hg) et acide nitrique (HNO3).
Il peut vous servir: Clausius-Clapeyron Equation: à quoi sert, des exemples, des exercicesDans l'une des études les plus importantes sur la structure de ce composé, les chercheurs suggèrent que pour obtenir de plus grandes performances pendant leur préparation, la première moitié du volume total d'éthanol doit être ajoutée au mélange HG et HNO3 Avant que les gaz bruns ne disparaissent.
En d'autres termes, il est important que les oxydes d'azote soient présents afin que la réaction se déroule.
Ce qui se passe en premier, c'est la conversion de l'éthanol en acétaldéhyde. Selon certaines études, alors plus d'oxydation, de nitration, de décarboxylation et d'élimination de l'acide nitreux suit de sorte que le fulminat se forme.
J'utilise comme agent détonant d'autres explosifs
Applications de guerre
Les premières tentatives d'utiliser le mercure fulminate comme poussière explosive pour les armes à feu ont été frustrées par la vitesse et la violence extraordinaires de leur détonation.
Les canons et les fusils de chasse ont été détruits par de petites charges de ce composé. Cela s'est également produit avec des pièces d'artillerie et de grenades dans les tests militaires.
Cependant, en 1822, le Wright anglais l'a utilisé pour la première fois en tant que tireur dans ses fusils de chasse sportifs. Par la suite, à Brittany, son utilisation dans les mousquets d'infanterie a été mise en œuvre puis dans toute l'Europe.
 Au XIXe siècle, le fulminate de Mercury a été utilisé comme détonateur de nombreux types d'armes de guerre. Auteur: Vetsikas Dimitris. Source: Pixabay.
Au XIXe siècle, le fulminate de Mercury a été utilisé comme détonateur de nombreux types d'armes de guerre. Auteur: Vetsikas Dimitris. Source: Pixabay. Jusqu'au début des années 1900, c'était le seul détonateur utilisé pour le tir de projectiles de toute nature, jusqu'à ce que d'autres alternatives avec des composés plus sûrs et accessibles soient mis en œuvre.
Applications pacifiques
Ce composé a joué un rôle important dans le développement des explosifs à des fins pacifiques.
Son rôle dans l'invention de la dynamite par Alfred Nobel était très important. Ce scientifique a combiné la nitroglycérine, un puissant explosif, avec un matériau poreux, la terre de diatomées. Mais la détonation de ce mélange est difficile avec des étincelles ou des mèches.
Nobel a dépassé cette difficulté à utiliser des cartouches Fulminat Fulminate Mercury qui étaient fiables dans leur application. Cette combinaison permet actuellement son utilisation dans l'exploitation minière, l'exploitation des carrières, la construction du tunnel et le génie civil pour la construction de routes, les chemins de fer, les ports, etc.
Il peut vous servir: Buteno Il a été largement utilisé comme détonateur des explosions dans l'exploitation minière et la construction de routes. Auteur: Nyamdorj. Source: Pixabay.
Il a été largement utilisé comme détonateur des explosions dans l'exploitation minière et la construction de routes. Auteur: Nyamdorj. Source: Pixabay. Alfred Nobel lui-même a souligné l'importance fondamentale du mercure fulminate dans les développements de génie civil qui favorisaient la dynamite.
Des risques
C'est un composé très instable et extrêmement explosif.
 Auteur: Clker-Free-Vector-Images. Source: Pixabay.
Auteur: Clker-Free-Vector-Images. Source: Pixabay. Il produit une toxicité aiguë. Il est toxique s'il est ingéré, inhalé ou s'il entre en contact avec la peau. Produit facilement la dermatite de contact. Il cause des dommages aux organes internes si la personne est exposée de manière répétitive ou prolongée.
Très toxique pour la vie aquatique et terrestre avec un danger à long terme continu.
Les références
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- OU.S. Bibliothèque nationale de médecine. (2019). Le mercure diffère. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Munroe, C.ET. (1912). Note sur la production de mercure fulminate. Journal of Industrial & Engineering Chemistry 1912, 4, 2, 152-153. Récupéré des pubs.ACS.org.
- Kurzer, F. (2000). Acide fulminique dans l'histoire de la chimie organique. J Chem. Éduquer. 2000, 77, 7, 851. Récupéré des pubs.ACS.org.
- Beck, W. et klapötke, t.M. (2008). Mercury Fulminate: étude DFT ONC-HG-CNO ou CNO-HG-ENC-A. Journal of Molecular Structure: Theochem 848 (2008) 94-97. Récupéré de ScienceDirect.com.
- Wilson, E. (2007). Mercury fulminate Reveed. Archives de nouvelles chimiques et d'ingénierie 2007, 85, 36, 10. Récupéré des pubs.ACS.org.
- Brun, m.ET. et avaler, g.M. (1981). La décomposition thermique des sels d'argent (i) et de mercure (ii) du 5-nitrotrazole et du mercure (ii) fulminate. Thermochimica Acta, 49 (1981) 333-349. Récupéré de ScienceDirect.com.
- Alderson, H.ET. (1910). À une nouvelle vocation dermatose. Dermatite due au fulminate sèche du mercure. Cal State J Med 1910 AP; 8 (4): 114. NCBI a récupéré.NLM.NIH.Gouvernement.
- Fondation Wikimedia (2020). Mercure (ii) Fulminate. Récupéré de.Wikipédia.org.
- « Structure du chlorure de mercure (II), propriétés, obtention, utilisations
- Caractéristiques et contributions des civilisations agricoles »

