Structure du chlorure de mercure (II), propriétés, obtention, utilisations
- 1481
- 357
- Adam Mercier
Il Chlorure de mercure (II) Il s'agit d'un composé inorganique formé par un atome du mercure métallique (Hg) et de deux atomes de l'halogène chlore (CL). Le mercure est dans son état d'oxydation +2 et le chlore -1.
Sa formule chimique est HGCL2. C'est un solide cristallin légèrement volatil à température ambiante. Les syndicats parmi leurs atomes sont plus covalents que ioniques.
 Chlorure de mercure (II). MrGreen71 / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Chlorure de mercure (II). MrGreen71 / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Lors de la dissolution dans l'eau, il maintient sa structure moléculaire. Il est également soluble dans plusieurs solvants organiques. Par la lumière de la lumière, il a tendance à former du mercure métallique.
Dans le passé, il a été utilisé comme antiseptique et pour traiter certaines maladies infectieuses, à la fois chez l'homme et les animaux. Également comme insecticide pour contrôler les ravageurs tels que les fourmis et les termites.
Cependant, lorsque leur toxicité élevée est vérifiée, la plupart de ces utilisations ont été abandonnées et sont actuellement utilisées uniquement dans les laboratoires de chimie ou d'analyse biochimique.
Peut exploiter dans certaines conditions. C'est un composé toxique, il fait du mal aux humains, aux animaux et aux plantes. Il ne devrait jamais être jeté dans l'environnement. Il est également soupçonné d'être cancérigène.
[TOC]
Structure
Le chlorure de mercure est composé de Hg dans l'oxydation II et le chlore avec Valencia -1. Dans cet haluro, les liens entre les atomes ont un caractère covalent très marqué.
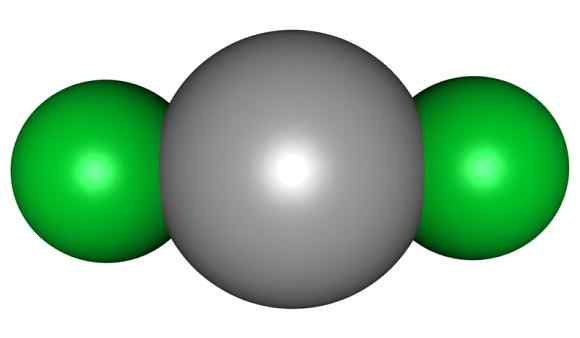 Molécule HGCL2. Gris = mercure; Vert = chlore. Arrowsmaster / Domaine public. Source: Wikimedia Commons.
Molécule HGCL2. Gris = mercure; Vert = chlore. Arrowsmaster / Domaine public. Source: Wikimedia Commons. Cela signifie que dans le verre, le composé maintient sa structure moléculaire Cl-Hg-Cl où la distance Hg-Cl est similaire à celle dans un état gazeux, tandis que dans le verre, la distance avec les atomes de chlore d'autres molécules est beaucoup âgé.
 Arrangement des molécules HGCL2 Dans le verre. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons.
Arrangement des molécules HGCL2 Dans le verre. Benjah-Bmm27 / Domaine public. Source: Wikimedia Commons. À l'état gazeux, il est clairement moléculaire et aussi en solution aqueuse.
Nomenclature
- Chlorure de mercure (II)
- Chlorure mercurique
- Bichlorure de mercure
- Dicloromercurio
Propriétés
État physique
Crystaux blanc cristallin blanc, Rombic.
 Chlorure mercurique solide. Leiem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Chlorure mercurique solide. Leiem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Poids moléculaire
271,5 g / mol
Point de fusion
280 ºC
Point de sublimation
À 300 ° C Sublima, c'est-à-dire qu'il va directement du solide à gaz.
Densité
5,6 g / cm3
Solubilité
Petite eau soluble: 7,31 g / 100 ml à 25 ° C. Alcool soluble: 33 g / 100 ml à 25 ° C. Acétate d'éthyle soluble. Little Soluble in Ether: 4 g / 100 ml. Quelque chose de soluble dans le benzène.
Il peut vous servir: Helmholtz Free Energy: Unités, comment il est calculé, exercices résoluspH
Une solution de 0,2 moles / L a un pH de 3,2-4,7.
Propriétés chimiques
En solution aqueuse, il y a presque exclusivement (∼ 99%) sous la forme d'une molécule HGCL2. Cependant, il subit une certaine hydrolyse:
HGCL2 + H2Ou ⇔ hg (oh) cl + h+ + CL-
HGCL2 + 2 h2Ou ⇔ hg (oh)2 + 2 h+ + 2 CL-,
Il présente une solubilité marquée dans les solvants organiques, où il prend la forme de dimères, c'est-à-dire deux molécules liées.
En présence de matière organique et par action de la lumière du soleil, il est réduit en formant du chlorure de mercure (I) (HGCL) puis en mercure métallique.
HGCL2 + Sunlight → HGCL → HG0
Avec une solution d'hydroxyde de sodium (NaOH) génère un précipité jaune jaune (HGO).
Il est incompatible ou réagit avec les formes, les sulfites, les phosphates, les sulfures, la gélatine, l'albumine, les alcalis, l'ammoniac, l'hydroxyde de calcium, les bromures, les carbonates, le fer, le cuivre, le plomb, les salts d'argent et certains matériaux végétaux.
Autres propriétés
En raison entre autres choses à son caractère le plus covalent que ionique, il est légèrement volatile à température ambiante et il est appréciable à 100 ° C.
Obtention
Vous pouvez préparer l'oxydation du mercure métallique (HG0) avec du chlore gazeux (Cl2). Lors du chauffage et de l'atteinte de plus de 300 ° C, une flamme apparaît et une vapeur recueillie est sublimée et lorsque les cristaux HGCL sont formés2.
Hg + cl2 + Chauffer → HGCL2
Il est également obtenu en chauffant le sulfate de mercure (II) à sec avec du chlorure de sodium. Vapeurs HGCL2 que les subliman sont collectés et condensés à un solide cristallin.
HGSO4 + 2 NaCl → HGCL2 + N / A2Swin4
La réaction entre l'oxyde de mercure (II) avec de l'acide chlorhydrique en quantités stoechiométriques produit des cristaux de HGCL2 Lorsque le milieu est refroidi.
HGO + 2 HCL → HGCL2 + H2SOIT
Les cristaux peuvent être purifiés par recristallisation et sublimation.
Applications
Dans les laboratoires chimiques
Il est utilisé comme réactif dans diverses analyses chimiques. Il permet la préparation d'autres composés de mercure, tels que l'iodure de mercure (II), l'oxyde de mercure (II), le chlorure de mercure (I), le chlorure d'ammonium et de mercure (II).
Peut vous servir: fluorure: historique, propriétés, structure, obtention, risques, utilisationsDans les laboratoires de pathologie
Il fait partie de la solution acétique de Zenker, qui est utilisée pour traiter les échantillons ou les échantillons de biopsies de moelle osseuse. Les tissus sont rapidement réglés avec d'excellents détails histologiques à observer au microscope.
 Parfois HGCL2 Il est utilisé dans les laboratoires de pathologie. Auteur: Ernesto Eslava. Source: Pixabay.
Parfois HGCL2 Il est utilisé dans les laboratoires de pathologie. Auteur: Ernesto Eslava. Source: Pixabay. Utilisations abandonnées
À l'époque médiévale et jusqu'au début du XX, il a été utilisé dans diverses applications, car son effet nocif pour la santé était inconnu.
- Comme traitement de certaines maladies, antiseptique topique et désinfectant.
 Dans le passé hgcl2 Il a été utilisé pour traiter la syphilis. g. H. Fox / domaine public. Source: Wikimedia Commons.
Dans le passé hgcl2 Il a été utilisé pour traiter la syphilis. g. H. Fox / domaine public. Source: Wikimedia Commons. - En médecine vétérinaire en tant qu'agent caustique, désinfectant et antiseptique.
- Dans l'agriculture, il a agi comme un fongicide, pour contrôler les vers terrestres, comme l'insecticide et le répulsif des cafards, des fourmis et des termites, et comme un désinfectant pour protéger les graines et les ampoules.
- Pour la conservation du bois, agent chimique pour embaumer et conserver les échantillons anatomiques.
- Comme catalyseur dans l'obtention de chlorure de vinyle à partir de l'acétylène.
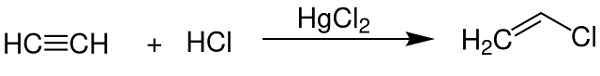 Le chlorure de mercure (II) sert de catalyseur dans l'obtention de certains composés chimiques. Chem Sim 2001 / Domaine public. Source: Wikimedia Commons.
Le chlorure de mercure (II) sert de catalyseur dans l'obtention de certains composés chimiques. Chem Sim 2001 / Domaine public. Source: Wikimedia Commons. - En électrode en aluminium.
- Pour marquer le fer et l'acier.
- En tant que réactif photographique.
- Dans l'impression de tissus, en tant que mordant pour le lapin et la fourrure de ricin, pour la teinture en bois.
- En tant que composant des batteries séchées.
Des risques
Pour la santé
C'est un composé corrosif et extrêmement toxique s'il est ingéré, car il peut provoquer la mort. Attaque le tractus gastro-intestinal et le système rénal. Provoquer de graves brûlures sur la peau et les yeux.
Une exposition prolongée ou répétée à ce composé cause des dommages aux organes internes. Toutes les formes de mercure sont toxiques et le HGCL2 est l'un des plus toxiques.
On soupçonne qu'il s'agit du cancérogène, qui provoque des défauts génétiques et des dommages à la fertilité.
Danger d'incendie
Bien qu'il ne soit pas du carburant peut exploser lors de l'application de la chaleur. Quand il décompose les gaz toxiques toxiques et mercure.
Mélanges HGCL2 Avec des métaux alcalins tels que le sodium ou le potassium, ils sont très sensibles aux coups et peuvent exploiter avec les impacts. Si vous entrez en contact avec l'ammoniac, les sulfures, l'acide oxalique et l'acétylène peuvent également exploser.
Peut vous servir: acide chlorhydrique (HCL)Effets sur l'environnement
Il est très toxique pour les organismes aquatiques et terrestres, ses effets durent au fil du temps. Il peut présenter une bioaccumulation tout au long de la chaîne alimentaire, à la fois dans les plantes et les animaux.
 Le chlorure mercurique ne devrait jamais être jeté dans l'environnement. Auteur: Naadjuuh. Source: Wikimedia Commons.
Le chlorure mercurique ne devrait jamais être jeté dans l'environnement. Auteur: Naadjuuh. Source: Wikimedia Commons. Il affecte la respiration, la photosynthèse et d'autres chemins métaboliques des plantes provoquant leur détérioration. Sa disposition dans l'environnement (ni l'eau ni les sols ni l'atmosphère) ne doivent pas être affectées).
Présence dangereuse dans certains remèdes naturels
Malgré sa toxicité, il existe des remèdes naturels et des herbes qui le contiennent, de sorte que les gens, sans le savoir, sont dangereusement exposés à ce composé.
Par exemple, en médecine traditionnelle chinoise, Calomel ou Qing Fen contient du HGCL2. C'est un remède utilisé comme diurétique, antiseptique, pommade à la peau, laxatif et appliqué à l'extérieur pour l'inconfort de la dentition chez les enfants.
 Certains médicaments naturels contrôlés peuvent contenir du HGCL2. Auteur: les êtres Silvija. Source: Pixabay.
Certains médicaments naturels contrôlés peuvent contenir du HGCL2. Auteur: les êtres Silvija. Source: Pixabay. Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Chlorure mercurique. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Lester, S.C. (2010). Traitement des échantillons. Fixation acétique de Zenker (orange). Dans Manual of Surgical Pathology (troisième édition). Récupéré de ScienceDirect.com.
- Clarksson, T.W. (2001). Agents. Proprietes physiques et chimiques. Dans Handbook of Peticid Toxicology (deuxième édition). Récupéré de ScienceDirect.com.
- Fretham, s.J.B. et al. (2015). Mercure et neurodégénérescence. Remèdes naturels et herbes contenant du HG. Dans les nutraceutiques bioactifs et les compléments alimentaires dans une maladie neurogique et cérébrale. Récupéré de ScienceDirect.com.
- Chevalier, s. et al. (2014). Distribution et abondance des plantes aquatiques - Impacts humains. POLUTANTS CHIMIQUES. En modulation de référence dans les systèmes terrestres et les sciences de l'environnemento. Récupéré de ScienceDirect.com.
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Ciavatta, L. et Grimaldi, m. (1968). L'hydrolyse du chlorure de mercure (II), HGCL2. Journal of Inorganic and Nuclear Chemistry, Volume 30, numéro 2, février 1968, pages 563-581. Récupéré de ScienceDirect.com.
- Fondation Wikimedia (2020). Mercure (ii) chlorure. Récupéré de.Wikipédia.org.
- « 21 scientifiques mexicains et leurs contributions historiques
- Structure fulminate de mercure, propriétés, obtention, utilisations »

