Structure du fluorure de magnésium, propriétés, synthèse, utilisations
- 4011
- 132
- Anaïs Julien
Il Fluorure de magnésium C'est un sel inorganique incolore dont la formule chimique est MGF₂. On le trouve dans la nature comme le minéral Sealíta. Il a un point de fusion très élevé et est très peu soluble dans l'eau. Il est relativement inerte, car, par exemple, sa réaction à l'acide sulfurique est lent et incomplet et résiste à l'hydrolyse avec de l'acide fluorhorique (HF) à 750ºC.
C'est un composé peu affecté par un rayonnement à haute énergie. De plus, il a un faible indice de réfraction, une forte résistance à la corrosion, une bonne stabilité thermique, une dureté significative et d'excellentes propriétés de transmission de lumière visible, UV (ultraviolet) et IR (infrarouge).

Ces propriétés ont d'excellentes performances dans le champ optique et, en outre, elles en font un matériau utile tel que le support de catalyseur, l'élément de revêtement, les lentilles anti-reflex et les fenêtres pour la transmission infrarouge, entre autres applications.
[TOC]
Structure
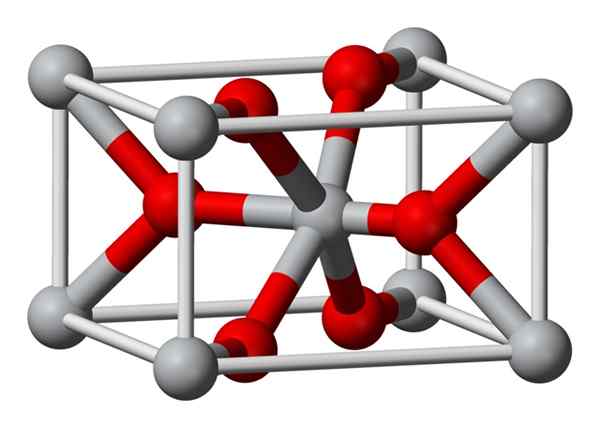
La structure cristalline du fluorure de magnésium préparé chimiquement est le même type que celui du minéral naturel de la sellaíta. Cristallise dans la classe dipiramidale du système tétragonal.
Les ions de magnésium (Mg2 +) sont situés dans un espace centré sur l'espace centré sur le tétragon, tandis que les ions fluorures (F-) se trouvent dans le même plan de leurs voisins Mg2 + et associés à ceux-ci, regroupés par paires avec chacun. La distance entre les ions Mg2 + et F- est de 2,07 Å (Angstroms) (2,07 × 10-10m).
Sa coordination cristalline est de 6: 3. Cela signifie que chaque ion Mg2 + est entouré de 6 ions F- et chaque ion f-, à son tour, est entouré de 3 mg2 + 5 ions.
La structure est très similaire à celle du Rutilo Mineral, qui est la forme naturelle du dioxyde de titane (TiO2), avec laquelle il a plusieurs propriétés cristographiques en commun.
Pendant son objet, le fluorure de magnésium ne précipite pas sous la forme d'un solide amorphe, car les ions Mg2 + et F n'ont pas tendance à former des complexes polymères en solution.
Propriétés
Il est intéressant de souligner que le fluorure de magnésium est un matériau birrefringent. Il s'agit d'une propriété optique qui vous permet de déplier un rayon de lumière incidente en deux rayons séparés qui se propagent à différents ondes et longueurs d'onde.
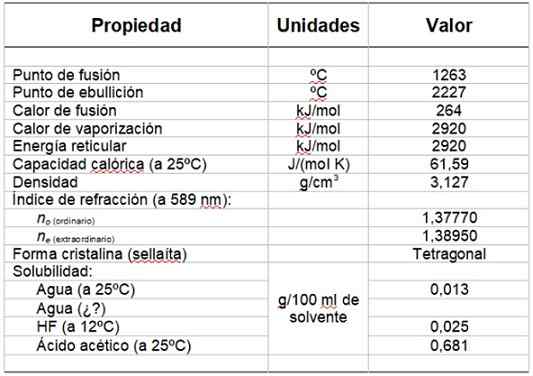
Peut vous servir: groupe hydroxyleLe tableau 1 montre certaines de ses propriétés.
Tableau 1. Propriétés physiques et chimiques du fluorure de magnésium.
Synthèse et préparation
Il peut être préparé de plusieurs manières, parmi lesquels les éléments suivants peuvent être mentionnés:
1-carré la réaction entre l'oxyde de magnésium (MGO) ou le carbonate de magnésium (MGCO3) avec de l'acide du fluorure (HF) 2:
MgO + 2 HF MGF2 + H2O
MGCO3 + 2 HF MGF2 + CO2 + H2O
Réaction de 2 pour le carbonate de magnésium et l'ammonium bifluoruro (NH4HF2), tous deux à l'état solide, à une température comprise entre 150 et 400 ° C2:
150-400ºC
MGCO3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-calento Une solution aqueuse de carbonate de magnésium et de fluorure d'ammonium (NH4F) en présence d'hydroxyde d'ammonium (NH4OH) à 60ºC 2:
60ºC, NH4OH
MGCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Le précipité du fluorure d'ammonium et de magnésium (NH4MGF3) est ensuite chauffé à 620 ° C pendant 4 heures pour obtenir du fluorure de magnésium:
620 ° C
NH4MGF3 MGF2 + NH3 + HF
4-comme le sous-produit de l'obtention du béryllium (be) et de l'uranium (u). Le fluorure de l'élément souhaité avec du magnésium métallique est chauffé dans un melting pot MGF2 2:
Bef2 + mg be + mgf2
Le chlorure de magnésium React 5-Hating (MGCL2) avec du fluorure d'ammonium (NH4F) en solution aqueuse à température ambiante 3:
25 ° C, H2O
Mgcl2 + 2 nh4f mgf2 + 2nh4cl
Étant donné que les méthodes de préparation MGF2 sont coûteuses, il y a des tentatives pour l'obtenir plus économiquement, parmi lesquelles la méthode de la production à partir de l'eau de mer.
Peut vous servir: Hydrure de calcium (CAH2): propriétés, réactivité et utilisationsCeci est caractérisé en ajoutant suffisamment d'ions fluorures (F-) à l'eau de mer, qui a une concentration abondante d'ions magnésium (Mg2 +), favorisant ainsi la précipitation de MGF2.
Les cristaux optiques de fluorure de magnésium sont obtenus par pression chaude à partir de MGF2 de haute qualité, obtenue, par exemple, par la méthode NH4HF2.
Il existe de nombreuses techniques pour préparer des matériaux de fluorure de magnésium, tels que la croissance du verre unique, le frittage (compactage à la moisissure ou à la forme) sans pression, chaud et frittage pressé avec micro-ondes.
Applications
Optique
Les cristaux MGF2 conviennent aux applications optiques car elles sont transparentes de la région UV à la région moyenne IR 2,10.
Comme un film inerte est utilisé pour modifier les propriétés de transmission de lumière des matériaux optiques et électroniques. L'une des principales applications est dans la technologie VUV Optics for Space Exploration Technology.
En raison de sa propriété Birrefringence, ce matériau est utile dans l'optique de polarisation, dans les fenêtres et prismes laser ECIMER (type laser ultraviolet utilisé en chirurgie oculaire).
Il convient de noter que le fluorure de magnésium utilisé dans la fabrication de matériaux optiques de film mince doit être exempt d'impuretés ou de composés qui sont source d'oxyde, comme l'eau (H2O), les ions hydroxyde (OH-), les ions carbonatés (CO3 = ), Les ions sulfate (SO4 =) et similaire 12.
Catalyse ou accélération des réactions
Le MGF2 a été utilisé avec succès comme support de catalyseur pour la réaction de l'élimination du chlore et l'ajout d'hydrogène dans le CFC (chlorofluorocarbures), des réfrigérants bien connus et des propergolages d'aérosols, et responsable des dommages aux couches d'ozone atmosphère.
Les composés résultants, HFC (hydrofluorocarbones) et HCFC (hydrochlorofluorocarbones), ne présentent pas cet effet nocif à l'atmosphère 5.
Il a également été utile comme support pour les catalyseurs de l'hydrodésulfration (élimination du soufre) des composés organiques.
Peut vous servir: équilibre chimique: explication, facteurs, types, exemplesAutres utilisations
Les matériaux générés par le graphite, le fluor et le MGF2 entrelacer.
L'Eutctic formé par NAF et MGF2 présente des propriétés de stockage d'énergie dans la chaleur latente, il a donc été considéré pour une utilisation dans les systèmes d'énergie solaire.
Dans le domaine de la biochimie, le fluorure de magnésium, ainsi que d'autres fluorures métalliques, sont utilisés pour inhiber les réactions de transfert de phosphoryle dans les enzymes.
Récemment, les nanoparticules MGF2 ont été testées avec succès en tant que vecteurs de placement de médicament dans les cellules malades pour le traitement du cancer.
Les références
- Buckley, H.ET. et Vernon, W.S. (1925) XCIV. La structure cristalline du fluorure de magnésium. Série de magazines philosophiques 6, 49: 293, 945-951.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique, volume 11, cinquième édition, John Wiley & Sons. ISBN 0-471-52680-0 (V.onze).
- Peng, Minhong; Cao, Weiping; et chanson, Jinhong. (2015). Préparation de la céramique translucide MGF2 par un frittage à chaud. Journal de l'Université Wuhan de Technology-mater: SCI. Élégant. Vol. 30 Non. 4.
- Не démar.С. (2011). Magnésium de fluor. Source: propre travail.
- Wojciechowska, Maria; Zielinski, Michal; et Piettowski, Mariusz. (2003). MGF2 en tant que support de catalyseur non conventionnel. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Magnésium de fluor (MGF2). Consulté le 07/12/2019 dans: Korth.de
- Sevonkaev, Igor et Matijevic, Egon. (2009). Formation de particules de fluorure de magnésium de différentes morphologies. Langmuu 2009, 25 (18), 10534-10539.
- Не démar.С. (2013). Magnésium de fluor. Source: propre travail.
- Tao Qin, Peng Zhang et Weiwei Qin. (2017). Une nouvelle méthode pour synthétiser les sphères de fluorure de magnésium à faible coût de l'eau de mer. Ceramics International 43 (2017) 14481-14483.
- Encyclopédie de la chimie industrielle de l'Ullmann (1996) Fifth Edition. Volume A11. VCH VERLAGSGELLSCHAFT MBH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingénieurs inspectant le miroir principal du télescope spatial Hubble 8109563. Source: Mélanger.Msfc.pot.Gouvernement
- « Origine d'écriture pictographique, caractéristiques et exemples
- Caractéristiques et exemples des transactions commerciales »

