Structure du fluorure de lithium, propriétés, obtention, utilisations

- 4455
- 187
- Prof Noah Collet
Il Fluorure de lithium C'est un solide inorganique dont la formule chimique est la vie. Est formé par des ions liés+ et f- qui sont unis à travers un lien ionique. Il se trouve en petites quantités dans plusieurs minéraux, en particulier les silicates tels que la lépidolite, l'eau de mer et dans de nombreux puits minéraux.
Il a été largement utilisé sur les dispositifs optiques en raison de sa transparence dans une large gamme de longueurs d'onde, du spectre infrarouge (IR) à l'ultraviolet UV, à travers le visible.
 Lépidolite, minéral qui contient de petites quantités de fluorure de vie. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Lépidolite, minéral qui contient de petites quantités de fluorure de vie. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Il a également été utilisé sur des appareils pour détecter les rayonnements dangereux dans les emplois dans lesquels les gens sont exposés à ceux-ci pendant une courte période. De plus, il est utilisé comme matériau pour faire fondre l'aluminium ou pour faire des verres ou des verres en verre et fabrication en céramique.
Il sert de matériau pour couvrir les composants des batteries au lithium-ion et pour empêcher la perte initiale de chargement de ces.
[TOC]
Structure
Le fluorure de lithium est un composé ionique, c'est-à-dire formé par l'union de la li cation+ et l'anion f-. La force qui les maintient ensemble est électrostatique et est appelée liaison ionique.
Lorsque le lithium est combiné, il donne un électron au fluor, tous deux étant plus stables que la manière initiale, comme expliqué ci-dessous.
L'élément lithium a la configuration électronique suivante: [il] 12 2s1 Et lorsque vous donnez un électron, la structure électronique est comme ceci: [il] 12 ce qui est beaucoup plus stable.
L'élément fluor dont la configuration électronique est: [ne] 1s2 2s2 2 P5, En acceptant l'électron est la forme [ne] 1s2 2s2 2 P6, plus stable.
Nomenclature
- Fluorure de lithium
- Fluorolitio
Peut vous servir: oxydes non métalliques- Monofluorure de lithium
Propriétés
État physique
Solide blanc, qui cristallise dans la structure cubique, comme le chlorure de sodium NaCl.
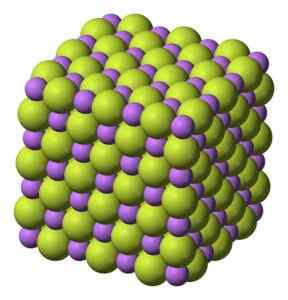 Structure cubique des cristaux de fluorure de lithium LIF. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Structure cubique des cristaux de fluorure de lithium LIF. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Poids moléculaire
26 g / mol
Point de fusion
848.2 ºC
Point d'ébullition
1673 ºC, bien qu'il soit volatilisé à 1100-1200 ºC
Densité
2 640 g / cm3
Indice de réfraction
1 3915
Solubilité
Peu soluble dans l'eau: 0,27 g / 100 g d'eau à 18 ºC; 0,134 g / 100 g à 25 ºC. Soluble dans un milieu acide. Insoluble dans l'alcool.
Autres propriétés
Ses vapeurs ont des espèces dimiques (LIF)2 et trimeric (LIF)3. Avec hf fluorhorhorique forme lihf lithium2; Avec l'hydroxyde de lithium, il forme un double sel de vie.Lio.
Obtention et emplacement
Le fluorure de lithium LIF peut être obtenu par réaction entre l'acide fluorhorhorique HF et l'hydroxyde de lithium LioH ou le lithium de carbonate de lithium2CO3.
Cependant, il est présent en petites quantités dans certains minéraux tels que la lépidolite et l'eau de mer.
 Le fluorure de lithium se trouve en petites quantités dans l'eau de mer. Adeeb Atwan [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons.
Le fluorure de lithium se trouve en petites quantités dans l'eau de mer. Adeeb Atwan [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons. Applications
Dans les applications optiques
Le LIF est utilisé sous forme de cristaux compacts dans les spectrophotomètres infrarouges (IR) en raison de l'excellente dispersion qu'ils ont dans l'intervalle de longueur d'onde entre 4000 et 1600 cm-1.
Les cristaux Lif Lif sont obtenus à partir de solutions saturées de ce sel. Il peut remplacer les cristaux de fluorite naturels dans divers types de dispositifs optiques.
Des cristaux grands et purs sont utilisés dans les systèmes optiques pour la lumière ultraviolette (UV), les monochromateurs IR et RI et les rayons X (0,03-0,38 nm).
 Life Lif Fluoruro Crystal, à l'intérieur d'un bécher. V1adis1av [domaine public]. Source: Wikimedia Commons.
Life Lif Fluoruro Crystal, à l'intérieur d'un bécher. V1adis1av [domaine public]. Source: Wikimedia Commons. Il est également utilisé comme matériau de revêtement optique pour la région UV en raison de sa large bande optique, supérieure à celle des autres fluorures métalliques.
Il peut vous servir: métaux alcalinotherresSa transparence dans les UV lointains (90-200 nm) le rend idéal en tant que revêtement protecteur dans les miroirs en aluminium (AL). Les miroirs LIF / AL ont une utilisation dans les systèmes de télescope optiques pour les applications spatiales.
Ces revêtements sont obtenus par dépôt physique de dépôt de vapeur et de couche au niveau atomique.
Dans les détecteurs de rayonnement ionisants ou dangereux
Le fluorure de lithium a été largement utilisé dans les détecteurs thermoluminescents pour les photons, les neutrons et les rayonnements β (bêta).
Les détecteurs thermoluminescents maintiennent l'énergie du rayonnement lorsqu'ils sont exposés à cela. Par la suite, lors de leur chauffage, libérez l'énergie stockée sous forme lumineuse.
Pour cette application, le LIF est généralement daté avec des impuretés de magnésium (Mg) et du titane (TI). Ces impuretés génèrent certains niveaux d'énergie qui agissent comme des trous où les électrons libérés par rayonnement sont piégés. Lorsque le matériau a ensuite chauffé, ces électrons reviennent à leur état d'énergie d'origine émettant la lumière.
L'intensité de la lumière émise dépend directement de l'énergie absorbée par le matériau.
Les détecteurs de LIF thermoluminescents ont été testés avec succès pour mesurer des champs de rayonnement complexes, tels que ceux présents dans le grand collisionneur de hadrons, ou LHC (pour son acronyme pour l'anglais Grand collisionneur de hadrons), situé à l'Organisation européenne pour la recherche nucléaire, connue sous le nom de CERN (pour son acronyme de français Congseil Européen verser le nuclére de la Recherche).
Radiation dans les expériences réalisées dans la mesure.
Comme matériau pour préliquer la cathode de batterie au lithium
Le LIF a été testé avec succès sous forme de nanocomposites avec du cobalt (CO) et du fer (foi) comme matériel pour la prélitiation (traduction de l'anglais Prélitation) du matériau de cathode de batterie lithium -on.
Peut vous servir: éther éthyliquePendant le premier cycle de charge ou la phase de formation d'une batterie au lithium ion, l'électrolyte organique est décomposé pour former une phase solide à la surface de l'anode.
Ce processus consomme du lithium de la cathode et réduit l'énergie entre 5 et 20% de la capacité totale de la batterie au lithium ion.
Pour cette raison, la prélitiation électrochimique de la cathode a été étudiée, qui génère une extraction électrochimique du lithium du nanocomposé, qui agit comme un donneur de lithium, évitant ainsi la consommation de lithium de la cathode.
Les nanocomposites LIF / CO et LIF / Fe ont une grande capacité à donner du lithium à la cathode, étant facile à synthétiser, stable dans les conditions de traitement de l'environnement et de la batterie.
 Batterie aux ions lithium. Auteur: M.ちゅら さん. Lithium_battery * Journée de la photographie, août 2005 * Personne de photographie Aney. Source: Wikimedia Commons.
Batterie aux ions lithium. Auteur: M.ちゅら さん. Lithium_battery * Journée de la photographie, août 2005 * Personne de photographie Aney. Source: Wikimedia Commons. Dans plusieurs utilisations
Le fluorure de lithium est utilisé comme compteur de soudage, en particulier l'aluminium, et dans les revêtements de tige de soudage. Il est également utilisé dans les cellules de réduction de l'aluminium.
Il est largement utilisé dans la fabrication de verre (comme ceux des objectifs) dans lequel le coefficient d'expansion diminue. Il est également utilisé dans la fabrication des céramiques. De plus, il a utilisé dans la fabrication d'émaux et de vernis vitreux.
Le LIF est un composant de carburant pour les roquettes et les carburants pour certains types de réacteurs.
LIF est également utilisé dans les diodes émettrices de lumière ou les composants photovoltaïques, pour l'injection d'électrons en couches internes.
Les références
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- OU.S. Bibliothèque nationale de médecine. (2019). Lithium au fluor. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Obryk, b. et al. (2008). La réponse de différents types de détecteurs de fluorure de lithium TL à des champs de rayonnement mixte à haute alirgie. Mesures de rayonnement 43 (2008) 1144-1148. Récupéré de ScienceDirect.com.
- Soleil, et. et al. (2016). Dans la synthèse chimique du milieu du fluorure de lithium / nanocomposite métal. Nano Letters 2016, 16, 2, 1497-1501. Récupéré des pubs.ACS.org.
- Hennessy, J. et Nikzad, s. (2018). Dépôt de couche atomique de revêtements optiques au fluorure de lithium pour l'ultraviolet. Inorganics 2018, 6, 46. MDPI a récupéré.com.
- « 10 expériences scientifiques pour le secondaire physique, la chimie, la biologie
- Structure d'acide méthylmalonique, propriétés, synthèse, utilisations »

