Échelle de pause
- 1160
- 153
- Prof Noah Collet
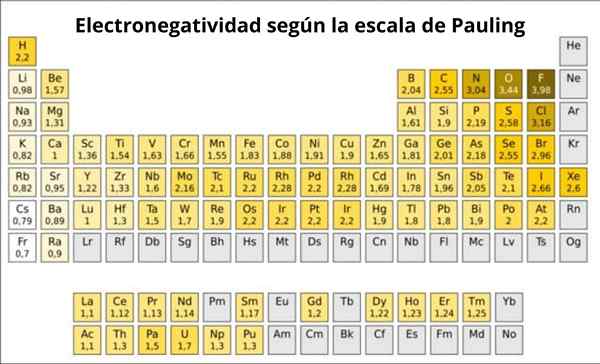 Figure 1. Échelle de pause. Source: Wikimedia Commons.
Figure 1. Échelle de pause. Source: Wikimedia Commons. Quelle est l'échelle Pauling?
La Échelle de pause Il s'agit d'une échelle arbitraire utilisée en chimie pour exprimer Électronégativité des éléments. Ceci est défini comme la tendance d'un certain atome à attirer des électrons lorsqu'il est combiné avec un autre atome.
En ce sens, les éléments d'électronégativité élevés ont tendance à gagner facilement les électrons. Ce ne sont pas des métaux, alors que pour leur part, moins les éléments électronégatifs tels que les métaux, il leur est plus facile de produire des électrons.
Par conséquent, connaître l'électronégativité d'un élément a une idée du type de lien capable de se former lorsqu'il est combiné avec un autre. Nous verrons cela avec un exemple numérique plus tard.
Avec ces informations, vous pouvez prédire de nombreuses propriétés qu'un composé aura, quelque chose de très utile en chimie expérimentale et pour la science des matériaux, où de nouveaux composés sont continuellement créés.
Cependant, il est pratique de clarifier que malgré son importance, il n'y a pas de moyen unique de déterminer l'électronégativité; L'échelle Pauling n'est qu'une des différentes formes proposées pour la trouver, bien qu'elle soit l'une des plus utilisées.
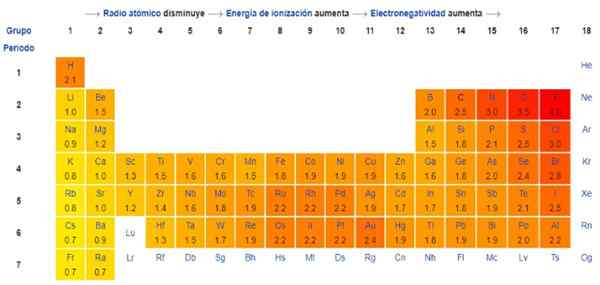
En fait, Pauling's est une échelle arbitraire dans laquelle une valeur numérique est attribuée à chaque élément du tableau périodique, qui reflète son électronégativité. Nous le voyons dans la figure 1, où vous avez l'électronégativité de chaque élément, comme cela a été attribué par le prix Nobel de Linus Pauling (1901-1994) vers 1939.
L'électronégativité des éléments
Pauling, à côté de Don M. Yost, a trouvé les valeurs de l'électronégativité empiriquement, à travers des données expérimentales obtenues en mesurant l'énergie de liaison.
Pauling affecté au fluor.0. Ainsi, lorsque le fluorure forme des liens, il présente la tendance la plus élevée pour attirer les électrons parmi tous les éléments.
Il peut vous servir: numéro de coordination: ce qui est, calcul, exemplesLe deuxième est l'oxygène, avec 3.5 et troisième est de l'azote avec 3.0. Les deux sont situés au-dessus et à droite de la table.
D'un autre côté, à l'extrémité opposée, l'élément le moins électronégatif est le césium, dont le symbole est CS, situé à gauche de la table, que Pauling a attribué le numéro 0.7.
Électronégativité dans le tableau périodique
En général et comme observé dans la figure 1, l'électronégativité - et l'énergie d'ionisation - augmente de gauche à droite dans le tableau périodique. La tendance générale indique également une diminution lors du passage de haut en bas.
Par conséquent, les éléments les plus électronégatifs les auront à l'angle supérieur droit du tableau: fluor, oxygène, chlore, azote. Le moins électronégatif - ou le plus électropositif s'ils sont préférés - seront à gauche: lithium, sodium, potassium et les autres éléments du groupe 1 - la colonne de l'extrême gauche, correspondant aux métaux alcalins et alcalins-.
Dans chaque colonne, l'électronégativité diminue en augmentant le nombre atomique de l'élément, sauf dans les métaux de transition au centre, qui ne suivent pas cette tendance.
Un point important à mettre en évidence est que l'électronégativité est relative, ce n'est pas une propriété invariable de chaque élément, et n'est mesurée que par rapport à celle des autres éléments. Cela dépend beaucoup de l'état d'oxydation, de sorte que le même élément peut présenter une électronégativité différente, en fonction du type de composé qui se forme.
Lier la différence d'énergie
 Figure 2. Le chimiste américain Linus Pauling en 1955. Source: Wikimedia Commons.
Figure 2. Le chimiste américain Linus Pauling en 1955. Source: Wikimedia Commons. En chimie, un lien est la façon dont les atomes sont joints, identiques ou différents, pour former des molécules. Parmi les atomes se trouvent des forces qui les maintiennent ensemble.
Il existe plusieurs types de liens, mais deux sont considérés ici:
- Covalent, dans lequel les atomes d'électronégativités similaires partagent quelques électrons.
- Ionique, fréquent entre les atomes avec différentes électronégativités dans lesquelles l'attraction électrostatique prévaut.
Supposons que deux éléments A E B puissent former des molécules les uns avec les autres, notés AA et BB. Et ils sont également en mesure de se joindre pour former un composé AB, tout au long d'un certain type de lien.
Grâce à la participation des forces intermoléculaires, il y a de l'énergie dans le lien. Par exemple, l'énergie dans le lien aa est eAA, Dans le lien BB est le reflux et enfin dans le composé AB est eUN B.
Si la molécule AB sera formée par une liaison covalente, théoriquement l'énergie de liaison est la moyenne des énergies etAA et eBb:
ETUN B = ½ (eAA + ETBb)
Pauling calculé eUN B Pour plusieurs composés, il l'a mesuré expérimentalement et a déterminé la différence entre les deux valeurs, ce qu'elle a appelé δ:
Δ = | (eUN B) mesuré - (eUN B) Théorique | = | (EUN B) mesuré - ½ (eAA + ETBb) |
Pauling a raisonné comme ceci: si δ est très proche de 0, cela signifie que les électronégativités des deux éléments sont similaires et que le lien qui les unit est covalent. Mais si δ n'est pas petit, alors le lien entre A et B n'est pas covalent pur.
Plus la valeur absolue de δ est grande, plus la différence entre l'électronégativité des éléments A et B est grande et donc le lien qui sera de type ionique. Plus tard, le lecteur trouvera un exemple dans lequel, calculant Δ, il est possible de déterminer le type de lien d'un composé.
Équations pour l'électronégativité
À partir du fait que la différence d'énergie est le signal qui distingue la nature du lien, Pauling a fait de nombreuses expériences qui l'ont conduit à créer une expression empirique pour les électronégativités relatives de deux éléments à E b qui forment une molécule.
En dénotant une telle électronégativité telle que χ (lettre grecque "chi"), le pauling a défini Δ comme suit:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√δ
Peut vous servir: tanteo équilibre: étapes, exemples et exercicesNotez que Δ est une quantité positive. Fatia f = 0.102 qui semble multiplier la racine carrée de Δ est le facteur de conversion entre KJ (kilojoules) et EV (électrons-volt), les deux unités d'énergie.
Si à la place, les kilocalorories et l'électron-volt sont utilisés, la différence d'électronégativités est exprimée avec une formule similaire mais avec f = 0.208:
χ (a) - χ (b) = 0.208 murs
Pauling a commencé à affecter l'hydrogène la valeur de 2.1, une valeur antérieure obtenue par le chimiste Robert Mulliken. Il a choisi cet élément comme point de départ car il forme des liens covalents avec beaucoup d'autres.
Grâce à l'équation précédente, il a continué à attribuer des valeurs liées au reste des éléments. Il a réalisé que l'électronégativité augmente lorsqu'elle se déplace de gauche à droite et de haut en bas dans le tableau périodique, comme décrit dans la section précédente.
Exemple
Vous trouverez ci-dessous une liste d'éléments: N, J et M et leurs électronégativités respectives χ selon l'échelle Pauling:
-N: Χ = 4.0
-J: Χ = 1.5
-ET: Χ = 0.9
-M: Χ = 1.6
Parmi les composés suivants formés avec eux:
YJ, YN, MN et JM
Soulignez celui avec le plus grand caractère ionique et que dont la nature est covalente. Raison que votre réponse.
Solution
Selon les critères établis par Pauling, le composé avec le caractère ionique le plus élevé sera celui avec la plus grande différence entre les électronégativités, et donc une valeur plus grande de δ. Pour sa part, le composé avec la différence d'énergie la plus basse est celui qui a une liaison covalente.
Ensuite, nous calculerons la quantité de Δ pour chaque composé, comme suit:
Composé YJ
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Composé YN
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Composé MN
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
Composé JM
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
D'après les résultats ci-dessus, il s'ensuit que le composé du caractère ionique est le yn, dont δ = 9.61, tandis que le composé du caractère covalent est le jm, avec δ = 0.01.

