Équations d'équilibre thermique, applications, exercices

- 2908
- 156
- Jade Duval
L'équilibre thermique de deux corps en contact thermique est l'état qui est atteint après un temps suffisamment long pour que les températures des deux corps soient égales à.
Dans la thermodynamique, le contact thermique de deux corps (ou deux systèmes thermodynamiques) est compris comme une situation dans laquelle les corps ont un contact mécanique ou sont séparés mais en contact avec une surface qui ne permet que le passage de chaleur d'un corps à l'autre (surface diathermique ).
-
 Figure 1. Après un certain temps, la glace et les boissons atteindront leur équilibre thermique. Source: Pixabay
Figure 1. Après un certain temps, la glace et les boissons atteindront leur équilibre thermique. Source: Pixabay
En contact thermique, il ne devrait pas y avoir de réaction chimique entre les systèmes en contact. Il ne devrait y avoir que l'échange de chaleur.
Les situations quotidiennes dans lesquelles il y a des échanges de chaleur sont présentés avec des systèmes tels que des boissons froides et du verre, du café chaud et une cuillère à café, ou le corps et le thermomètre, parmi de nombreux autres exemples.
[TOC]
Lorsque deux systèmes ou plus sont en équilibre thermique?
La deuxième loi de la thermodynamique établit que la chaleur passe toujours du corps la plus haute température à la température la plus basse. Le transfert de chaleur cesse dès que les températures sont égalisées et que l'état d'équilibre thermique est atteint.
L'application pratique de l'équilibre thermique est le thermomètre. Un thermomètre est un appareil qui mesure sa propre température, mais grâce à l'équilibre thermique, nous pouvons connaître la température d'autres corps, comme celui d'une personne ou d'un animal.
Le thermomètre à colonne de mercure est placé en contact thermique avec le corps, par exemple sous la langue, et suffisamment de temps devrait atteindre l'équilibre thermique entre le corps et le thermomètre et que sa lecture ne varie pas plus.
Lorsque ce point est atteint, la température du thermomètre est la même que le corps.
La loi nulle de la thermodynamique établit que si un corps A est en équilibre thermique avec un corps C et que le même corps C est en équilibre thermique avec B, alors a et b sont en équilibre thermique même si entre A et B, il n'y a pas de contact thermique.
Nous concluons que deux systèmes ou plus sont en équilibre thermique lorsqu'ils ont la même température.
Équations d'équilibre thermique
Nous supposons un corps à la température initiale en contact thermique avec un autre corps B avec une température initiale TB. Nous supposons également que TA> TB, puis selon la deuxième loi, la chaleur est transférée de A à B.
Après un certain temps, l'équilibre thermique sera atteint et les deux corps auront la même température finale TF. Cela aura une valeur intermédiaire pour TA et TB, c'est-à-dire Ta> tf> TB.
La quantité de chaleur transférée de A à B sera QA = MA Ca (tf - Ta), où MA est la masse du corps a, ca la capacité de chaleur par unité de masse d'un y (tf - ta) la différence de température. Si TF est inférieur à celui-ci, QA est négatif, indiquant que le corps donne de la chaleur.
De même pour le corps B, vous devez QB = MB CB (TF - TB); Et si TF est supérieur à TB, QB est positif, indiquant que le corps B reçoit la chaleur. Comme le corps A et B sont en contact thermique entre eux, mais isolés de l'environnement, la quantité totale de chaleur échangée doit être nulle: QA + QB = 0
Alors ma ca (tf - ta) + mb cb (tf - tb) = 0
Température d'équilibre
Développement de cette expression et nettoyant la température TF, la température finale d'équilibre thermique est obtenue.
-
 Figure 2. Température d'équilibre finale. Source: auto-faite
Figure 2. Température d'équilibre finale. Source: auto-faite
Tf = (ma ca ta + mb cb tb) / (ma ca + mb cb).
En tant que cas particulier, considérons le cas selon lequel les corps A et B sont identiques en masse et en capacité thermique, dans ce cas, la température d'équilibre sera:
Tf = (ta + tb) / 2 ↔ si mA = mb et ca = cb.
Contact thermique avec changement de phase
Dans certaines situations, il arrive que lorsque deux corps sont placés en contact thermique, l'échange de chaleur provoque le changement d'état ou de phase dans l'un d'eux. Si cela se produit, il faut prendre en compte que pendant le changement de phase, il n'y a pas de changement de température dans le corps qui modifie son statut.
Si le changement de phase de l'un des corps en contact thermique se produit, le concept de chaleur latente L est appliqué, qui est l'énergie par unité de masse nécessaire au changement d'état:
Q = L ∙ M
Par exemple, faire fondre 1 kg de glace à 0 ° C, 333,5 kJ / kg sont nécessaires et cette valeur est la chaleur latente de la fusion de la glace.
Pendant la fusion, l'eau solide est changée en eau liquide, mais cette eau maintient la même température de glace pendant le processus de fusion.
Applications
L'équilibre thermique fait partie de la vie quotidienne. Par exemple, examinons cette situation en détail:
-Exercice 1
Une personne souhaite se baigner avec de l'eau tiède à 25 ° C. Dans un cube, place 3 litres d'eau froide à 15 ° C et dans la cuisine, chauffer l'eau jusqu'à 95 ° C.
Combien de litres d'eau chaude doit ajouter au cube d'eau froide pour avoir la température finale souhaitée?
Solution
Supposons que ce soit de l'eau froide et de l'eau chaude:
-
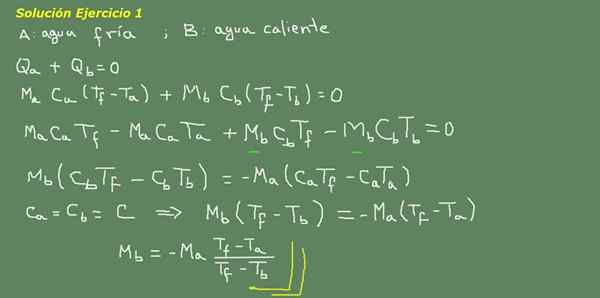 figure 3. Exercice 3 Solution. Source: auto-faite.
figure 3. Exercice 3 Solution. Source: auto-faite.
Nous proposons l'équation d'équilibre thermique, comme indiqué sur la planche de la figure 3 et à partir de là, nous effacons l'eau MB.
La masse initiale d'eau froide peut être obtenue car la densité de l'eau est connue, qui est de 1 kg pour chaque litre. C'est-à-dire que nous avons 3 kg d'eau froide.
MA = 3kg
Ensuite
MB = - 3 kg * (25 ° C - 15 ° C) / (25 ° C - 95 ° C) = 0,43 kg
Ensuite, il suffit de 0,43 LTS d'eau chaude pour enfin obtenir 3,43 litres d'eau tiède à 25 ° C.
Exercices résolus
-Exercice 2
Un morceau de métal de 150 g de masse est introduit et avec une température de 95 ° C dans un récipient contenant un demi-litre d'eau à une température de 18 ° C. Après un certain temps, l'équilibre thermique et la température de l'eau et du métal sont atteints est de 25 ° C.
Supposons que le conteneur avec de l'eau et la pièce métallique soit un thermos fermé qui ne permet pas d'échange de chaleur avec l'environnement.
Obtenir la chaleur spécifique du métal.
Solution
Nous allons d'abord calculer la chaleur absorbée par l'eau:
Qa = ma ca (tf - ta)
QA = 500G 1CAL / (G ° C) (25 ° C - 18 ° C) = 3500 calories.
C'est la même chaleur donnée par le métal:
QM = 150g cm (25 ° C - 95 ° C) = -3500 calories.
Ensuite, nous pouvons obtenir la capacité thermique du métal:
Cm = 3500 cal / (150g 70 ° C) = ⅓ cal / (g ° C).
Exercice 3
Vous avez 250 C.c. d'eau à 30 ° C. À cette eau qui se trouve dans un thermos isolant, 25 g de glaçons à 0 ° C sont ajoutés, dans le but de le refroidir.
Déterminer la température d'équilibre; c'est-à-dire la température qui restera une fois que toute la glace a fondu et que l'eau glacée s'est chauffée jusqu'à ce que l'eau qui avait initialement le verre.
Solution 3
Cet exercice peut être résolu en trois étapes:
- Le premier est la fusion de la glace qui absorbe la chaleur de l'eau initiale à fondre et à devenir de l'eau.
- Ensuite, la diminution de la température dans l'eau initiale est calculée, car elle a donné de la chaleur (QCED<0) para fundir el hielo.
- Enfin, l'eau fondue (de la glace) doit être thermiquement équilibrée avec l'eau qui existait initialement.
-
 Figure 4. Exercice 3 Solution. Source: auto-faite.
Figure 4. Exercice 3 Solution. Source: auto-faite.
Calculons la chaleur nécessaire à la fusion de la glace:
Qf = l * mh = 333,5 kJ / kg * 0,025 kg = 8 338 kJ
Ensuite, la chaleur attribuée par l'eau pour faire fondre la glace est QCED = -QF
Cette chaleur attribuée par l'eau descend sa température à une valeur t 'que nous pouvons calculer comme suit:
T '= t0 - qf / (ma * ca) = 22,02 ° C
Où CA est la capacité thermique de l'eau: 4,18 kJ / (kg ° C).
Enfin, la masse d'eau d'origine qui est maintenant à 22,02 ° C donnera de la chaleur à l'eau fondu de la glace à 0 ° C.
Enfin, la température d'équilibre sera atteinte après suffisamment de temps:
Te = (mA * t '+ mh * 0 ° C) / (mA + mh) = (0,25 kg * 22,02 ° C + 0,025 kg * 0 ° C) / (0,25 kg + 0,025 kg).
Enfin obtenant la température d'équilibre:
TE = 20,02 ° C.
-Exercice 4
Une pièce de plomb de 0,5 kg laisse le four à une température de 150 ° C, ce qui est assez en dessous de son point de fusion. Cette pièce est placée dans un récipient avec 3 litres d'eau à température ambiante de 20 ° C. Déterminez la température d'équilibre finale.
Calculez également:
- Quantité de chaleur délivrée par la conduite à l'eau.
- Quantité de chaleur absorbée par l'eau.
Données:
Chaleur de plomb spécifique: CP = 0,03 chaux / (g ° C); Chaleur d'eau spécifique: Ca = 1 chaux / (g ° C).
Solution
En premier lieu, nous déterminons la température d'équilibre finale TE:
Te = (ma ca ta + mp cp tp) / (ma ca + mp cp)
TE = 20,65 ° C
Ensuite, la quantité de chaleur attribuée par le plomb est:
QP = MP CP (TE - TP) = -1,94 x 10³ Lime.
La quantité de chaleur absorbée par l'eau sera:
Qa = ma ca (te - ta) = + 1,94x 10³ citron vert.
Les références
- Atkins, P. 1999. Chimie physique. Éditions Omega.
- Bauer, w. 2011. Physique pour l'ingénierie et les sciences. Volume 1. Mc Graw Hill.
- Giancoli, D. 2006. Physique: principes avec applications. 6e ... Ed Prentice Hall.
- Hewitt, Paul. 2012. Sciences physiques conceptuelles. 5e. Élégant. Pearson.
- Resnick, r. (1999). Physique. Vol. 1. 3e édition. en espagnol. Société de rédaction continentale S.POUR. de c.V.
- Rex, un. 2011. Fondamentaux de la physique. Pearson.
- Sears, Zemansky. 2016. Physique universitaire avec physique moderne. 14e. Élégant. Volume 1.
- SERAY, R., Jewett, J. (2008). Physique pour la science et l'ingénierie. Volume 1. 7e. Élégant. Cengage Learning.
- « Caractéristiques du système de production continu, avantages, exemples
- Les causes, le développement et les conséquences de la révolution libérale de l'Équateur »

