Solde de vapeur liquide

- 2868
- 288
- Jade Duval
Qu'est-ce que l'équilibre liquide-vapeur?
Il solde de vapeur liquide C'est un état dynamique qui établit un liquide, que ce soit une substance pure ou un mélange, avec la vapeur qui entoure et interagit avec sa surface. Pour se produire, le conteneur doit être fermé, sinon les courants d'air feraient évaporer lentement le liquide.
Lorsque le système est fermé, la pression exercée par les molécules de phase de vapeur grimpera au fil du temps. Un point viendra où la pression s'arrêtera; Il s'agit de la pression de vapeur du liquide, qui est une propriété physique de la question, étant indépendante de la taille du conteneur, ou du volume de liquide.
 Lorsqu'une boisson à gaz est découverte, son équilibre de vapeur liquide est perturbé, provoquant un déséquilibre des pressions à l'extérieur et à l'intérieur de la bouteille, et avec elle le bubb. Source: OpenStax, CC par 4.0, via Wikimedia Commons
Lorsqu'une boisson à gaz est découverte, son équilibre de vapeur liquide est perturbé, provoquant un déséquilibre des pressions à l'extérieur et à l'intérieur de la bouteille, et avec elle le bubb. Source: OpenStax, CC par 4.0, via Wikimedia Commons Chaque liquide, pur ou mélangé, aura une pression de vapeur associée qui dépendra de la volatilité de ses composants; Et donc, des forces intermoléculaires qui les maintiennent ensemble dans le liquide et à leur surface.
Cette pression peut être décrite en supposant l'idéalité des solutions, ou la miscibilité des composants d'un mélange. Pour ce faire, l'utilisation de diagrammes binaires est très utile, dans laquelle il est possible d'envisager la viabilité d'un processus de séparation.
L'équilibre liquide-vapeur est essentiel pour les infinos de processus de génie chimique, tels que les distillations fractionnaires et celles fabriquées avec de la vapeur d'eau, à travers laquelle distillé distillé dans les composants les plus volatils sont obtenus. C'est le cas de l'éthanol à 95.4% dans l'eau, étant le pourcentage d'alcool le plus accessible et économique sur le marché.
Substances pures
Les molécules d'une substance pure ne sont pas encore, mais passent d'un endroit à un autre grâce à une énergie cinétique intrinsèque. Cette énergie peut parfois être suffisamment grande pour surmonter les forces intermoléculaires qui "tirent" une molécule de particulier au sein du liquide. Ensuite, la molécule s'échappera de la surface du liquide à la phase de vapeur.
Dans la phase de vapeur, les molécules entreront en collision avec les parois internes du récipient, gagnant ou perdant une vitesse jusqu'à ce qu'ils retrouvent la surface du liquide, où une fois qu'ils vont intégrer le conglomérat des molécules de la phase liquide.
Peut vous servir: cobalt: structure, propriétés, applicationsAinsi, le temps se déroule jusqu'à ce que, à une certaine température (pour dire 25 ° C), le nombre de molécules qui échappent à la surface égale à celles qui pénètrent de vapeur. Il est donc dit qu'un équilibre liquide-vapeur a été établi dans une substance pure pour.
La pression de vapeur pour découvrir les parois internes du récipient, ainsi que la surface du liquide, seront égales à PPOURº, qui est constant et reproductible; Quelle que soit la grande ou la taille du conteneur ni le volume du liquide.
Mélanges
Dans les mélanges liquides, il y aura également un composant qui exerce une pression sur la surface liquide et les contours du conteneur. Votre pression de vapeur, comme on peut s'y attendre, sera composée de contributions de chacun des composants du mélange, pour dire, deux substances A et B. Ces mélanges peuvent être miscibles, partiellement miscible.
Miscible
Dans un mélange miscible entre A et B, les deux substances constituent une seule phase, qui à première vue ressemble à une substance pure. Ainsi, selon la loi de Dalton, la pression du mélange ou de la solution sera égale à:
Psoleil = PPOUR + PB +··· PToi
Être PToi Tout autre composant qui est également présent dans le mélange. Notez que PPOUR≠ pPOURº, c'est-à-dire que les pressions des substances dans le mélange ne sont pas les mêmes que celles de leurs états de haute pureté.
En supposant que la solution est idéale, les différences entre les interactions A-A, B-B et A-B sont évidentes. Cela peut être appliqué, par exemple, dans un mélange d'éthanol et de méthanol.
Par conséquent, les pressions de vapeur des composants dans le mélange dépendront de leurs quantités relatives dans la phase liquide, exprimées en fractions molaires xToi. Et c'est là que la loi de Raault intervient, qui cherche à relier la pression PPOUR Et PPOURº:
PPOUR = XPOUR PPOURº
Étant maintenant la pression totale égale à:
Psoleil = XPOUR PPOURº + xB PBº + ···
La phase de vapeur, en revanche, aura ses propres compositions, exprimées en fractions molaires Yi:
Yi = pToi / Psoleil
= XToi PToiº / psoleil
Diagramme binaire
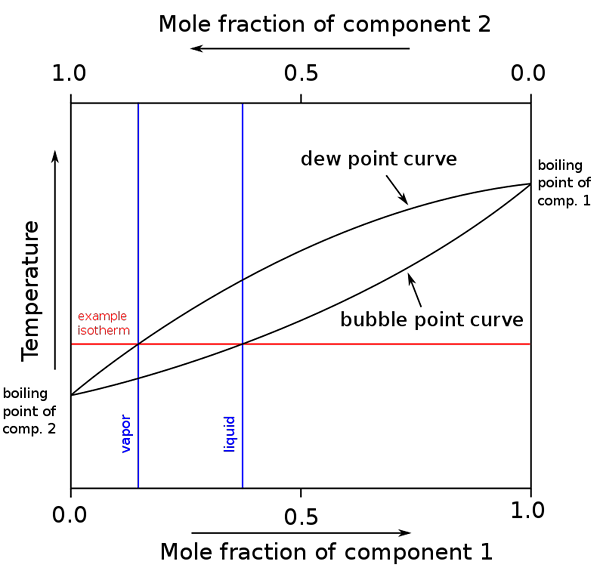 Diagramme des points d'ébullition et des compositions molaires pour un mélange binaire. Source: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC By-SA 2.5, via Wikimedia Commons
Diagramme des points d'ébullition et des compositions molaires pour un mélange binaire. Source: binary_boiling_point_diagram.PNG: H Padleckasderivative Work: Michbich, CC By-SA 2.5, via Wikimedia Commons Lorsque les fractions molaires des composants d'un mélange binaire (A + B) sont graphiques, selon la température ou la pression, des diagrammes binaires sont obtenus (voir ci-dessus). Cette forme particulière, la plus simple, correspond à celle des solutions idéales.
Peut vous servir: Volume molaire: concept et formule, calcul et exemplesLa zone au-dessus de «l'ovale» correspond à la phase de vapeur, tandis que la zone ci-dessous correspond à la phase liquide du mélange. Notez que lorsque la fraction molaire du composant 1 ou est 0 (x1= 0), la fraction molaire du composant 2 ou B sera égale à 1 (x2= 1), puis la pression de vapeur ne doit que b. Cette température devient le point d'ébullition de b.
Pendant ce temps, à l'autre extrémité (à droite), quand x2= 0 mais x1= 1, la pression de vapeur n'est que. Cette température devient celle de son point d'ébullition.
La ligne ovale inférieure correspond au point de bulle, c'est-à-dire lorsque la première bulle apparaît lorsque le mélange liquide est chauffé (augmentant le diagramme). Et la ligne supérieure correspond au point de rosée, c'est-à-dire lorsque la phase de vapeur se refroidit et que la première goutte apparaît (en descendant dans le diagramme).
Azéotrope
Dans de nombreuses solutions non idéales, nous aurons des azéotropes, qui sont des mélanges qui s'évaporent en maintenant leur composition constante; c'est-à-dire qu'ils s'évaporent comme s'ils étaient un composé pur.
Il est impossible de «briser» une composition azéotrope à travers plus d'étapes de distillation. Au lieu de cela, d'autres méthodes sont utilisées pour augmenter la pureté du composant souhaité.
Par exemple, le mélange éthanol-eau forme un azéotrope avec une composition 95.4 d'éthanol. Cela signifie qu'il est impossible, par les distillations, d'obtenir un éthanol avec une concentration supérieure à 95.4%; Il y aura toujours 4.6% d'eau restante. Si vous vouliez préparer de l'éthanol absolu (100%), il serait nécessaire d'utiliser des matériaux déshydratants ou d'autres voies de synthèse.
Dans un diagramme binaire, nous pouvons voir la présence d'un azéotrope, qui présente la forme suivante:
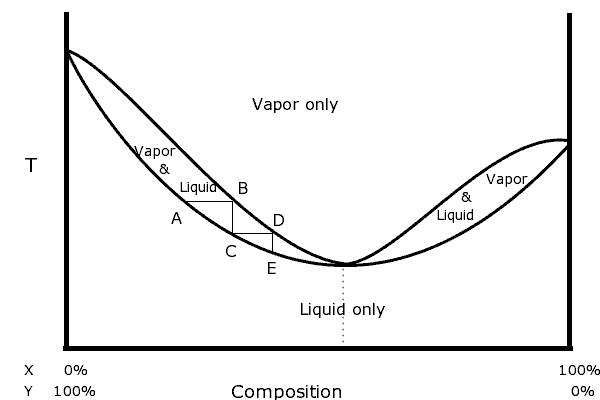 Diagramme binaire d'un mélange avec un azéotrope positif. Source: Karlhahn à l'anglais Wikipedia, domaine public, via Wikimedia Common
Diagramme binaire d'un mélange avec un azéotrope positif. Source: Karlhahn à l'anglais Wikipedia, domaine public, via Wikimedia Common À gauche du diagramme, on peut voir que dans «l'ovale», une région où nous avons l'équilibre liquide-vapeur, nous pouvons distiller en étapes consécutives (a, b, c, d et e) pour obtenir un de plus en plus riche Mélange dans le composant le plus volatil (x pour ce diagramme).
Dans le point azéotrope, cependant, le mélange x et y et bouil.
Peut vous servir: formule moléculaire: comment le sortir, exemples et exercicesPartiellement miscible
Dans les mélanges partiellement miscibles, ils se formeront, selon la température, deux phases reconnaissables: une riche en composante A et une autre riche en composant B. Les diagrammes binaires de ces cas sont beaucoup plus rigoureux et larges, car ils impliquent des régions où la vapeur coexiste avec les deux phases.
Insouciant
En parlant de mélanges non miscibles, chaque composant se comportera comme s'il était dans un état de haute pureté, car il interagit à peine avec les autres molécules. Par conséquent, la pression de vapeur pour ces mélanges sera égale à:
Psoleil = PPOURº + pBº + ··· PToiº
Le mélange bouillir à une température inférieure à celui des composants purs, car la pression du mélange non miscible sera plus élevée, car elle est égale à la somme des pressions de chaque composant dans son état pur. Plus de pression de vapeur implique qu'il est plus volatil et va donc bouillir à une température plus basse.
Applications
Distillations
Dans les distillations, en particulier au niveau industriel, les connaissances sur l'équilibre liquide-vapeur sont primaires. À partir des composants du mélange et de ses diagrammes de phase, il peut être calculé du nombre de plats nécessaires dans la construction d'une tour de fractionnement pour la séparation correcte desdits composants.
Distillation de vapeur d'eau
La vapeur d'eau peut être pompée à l'intérieur d'un mélange sous distillation. Lors de la vapeur d'eau bouillonnante à l'intérieur du liquide, la pression de vapeur du mélange augmentera, il bouilla donc à une température plus basse et aidera à extraire les composants les plus volatils (comme les essences).
Oiseau buvant
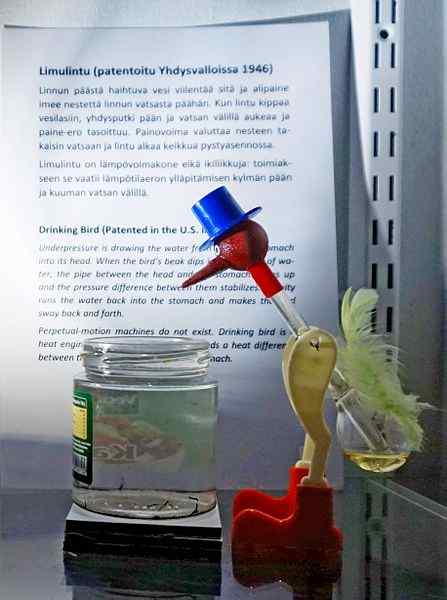 Oiseau de boire, l'un des jouets les plus ingénieux de tous les temps. Source: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons
Oiseau de boire, l'un des jouets les plus ingénieux de tous les temps. Source: Tiia Monto, CC BY-SA 4.0, via Wikimedia Commons Bien qu'il ne s'agisse pas précisément d'un équilibre de vapeur liquide, la vérité est que derrière le fonctionnement de l'oiseau buvant, plusieurs phénomènes thermodynamiques sont cachés.
Lorsque la tête de l'oiseau est mouillée, elle commence à se refroidir à mesure que l'eau s'évapore. Cette diminution de la température entraîne une diminution de la pression à l'intérieur de la tête de l'oiseau. Le chlorure de méthylène, situé à la base de l'oiseau, cherchera à équilibrer les pressions, coulant à travers un tube en verre qui relie la tête à la tête.
Le liquide s'élèvera à la tête de l'oiseau, le rendant plus lourd et inclinant son corps vers l'avant. L'oiseau "buvez ensuite de l'eau" et les pressions de vapeur équilibreront. Équilibrez les pressions, l'oiseau de l'oiseau reviendra à la position verticale et le cycle sera répété tandis que l'eau de la tête s'évapore à nouveau.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Walter J. Moore. (1962). Chimie physique. (Quatrième édition). Longmans.
- Wikipédia. (2020). Équilibre vapeur-liquide. Récupéré de: dans.Wikipédia.org
- Ed Vitz et al. (5 novembre 2020). Équilibre vapeur-liquide. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Limer Eric. (30 janvier 2018). Une explication absurdement détaillée du jouet d'oiseau à boire. Récupéré de: PopularMechanics.com
- Université d'Alicante. (s.F.). Sujet 4: Calcul de l'équilibre-vapeur. Diagrammes d'équilibre. [PDF]. Récupéré de: rua.Ua.est

