Structure de l'énolase, mécanisme d'action, fonctions
- 2490
- 472
- Adam Mercier
La Énolase C'est l'enzyme chargée de réaliser la conversion du D-2-phosphoglycérate (2pga) dans le phosphoenolpyruvate (PEP) dans la glycolyse et la réaction inverse dans la gluconéogenèse, deux voies métaboliques qui font partie du métabolisme énergétique cellulaire.
La décision de catalyser cette réaction dans l'une ou l'autre direction dépend de l'accès que la cellule au glucose a. C'est-à-dire des besoins d'adaptation de votre métabolisme à la dégradation ou à la synthèse afin d'obtenir l'énergie. Indispensable pour la réalisation de ses processus vitaux.
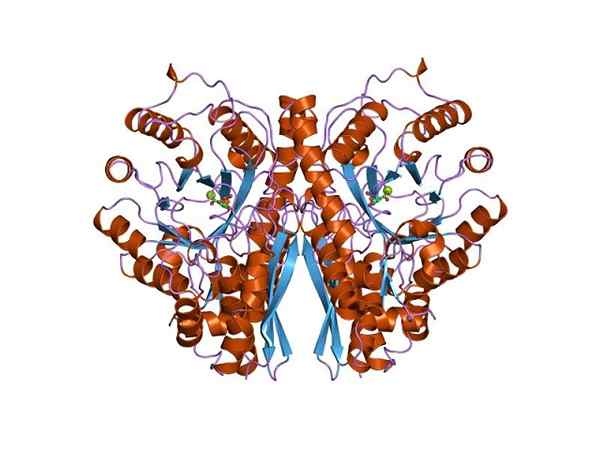
 Structure à trois dimensions de l'énolasa. Par Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domaine public (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons.
Structure à trois dimensions de l'énolasa. Par Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domaine public (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons. Étant donné que les deux routes métaboliques appartiennent au centre de l'arbre métabolique central des êtres vivants, il n'est pas étrange que la séquence d'acides aminés de cette protéine soit préservée dans les archéa, les bactéries et les eucaryotes. Et donc qui présentent des propriétés catalytiques similaires.
L'emplacement de l'énolase dans la cellule est limité au cytosol, un compartiment dans lequel la glycolyse (également appelée glycolyse) et la gluconéogenèse dans la plupart des organismes ont lieu.
Cependant, il a également été détecté dans d'autres compartiments cellulaires tels que la membrane plasmique de nombreuses cellules cancéreuses et cellules. Là, il semble être impliqué dans la facilitation des processus de diffusion cellulaire, une fonction totalement différente de sa fonction classique.
Les enzymes capables d'exécuter plus d'une fonction, comme le fait l'énolase, sont appelées enzymes au clair de lune.
[TOC]
Structure
La structure quaternaire du linus ou non dans ses ligands a été déterminée chez un grand nombre d'individus procaryotes et eucaryotes.
Chaque monomère présente deux domaines: un petit domaine amino-terminal et un plus grand domaine carboxyl-terminal. Le domaine N-terminal est composé de trois feuilles α et quatre β. Tandis que le C-terminal se compose de huit feuilles β qui alternent entre eux formant un baril β entouré de huit hélices α.
De plus, deux sites syndicaux pour les cations divalents se trouvent dans chaque monomère qui a été appelé "site de conformation" et "site catalytique". Le premier n'est pas très sélectif et peut rejoindre une grande variété de cations divalents en l'absence de substrat.
Peut vous servir: sphingolipides: quelles sont les caractéristiques, les fonctions, la synthèseTandis que le second se lie aux ions après que le substrat a rejoint l'enzyme. L'union des ions aux deux sites est vitale pour la réaction de procéder.
Enfin, il est important de mentionner que dans les homodimères, les monomères sont rejoints en maintenant une orientation parallèle. Par conséquent, le site actif est limité à la région centrale formée par ladite syndicat.
Cependant, un seul des deux monomères participe à la catalyse. Cela explique que la capacité des monomères à effectuer la réaction dans des conditions expérimentales.
Mécanisme d'action
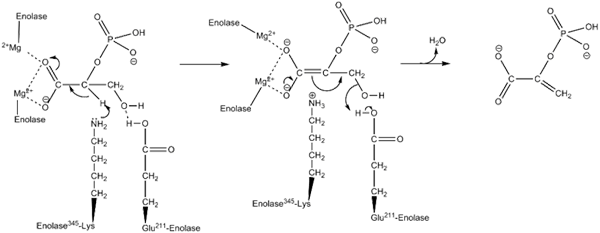 Mécanisme d'action utilisé par l'enzyme inolase. Par Kthompson08 en anglais wikipedia [Domaine public (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons.
Mécanisme d'action utilisé par l'enzyme inolase. Par Kthompson08 en anglais wikipedia [Domaine public (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons. Les études structurelles, ainsi que celles qui ont permis de déterminer les caractéristiques cinétiques et physicochimiques de l'énolasa, nous ont permis de comprendre leur mécanisme d'action.
La façon dont l'enzyme effectue la catalyse de la réaction est assez intéressante. Bien qu'un seul substrat soit impliqué, un mécanisme séquentiel ordonné est celui qui a été proposé.
Cela commence par l'union d'un ion de Mg2 + au site de conformation de l'un des monomères. Continu avec l'union du substrat au site actif suivi par l'union d'un deuxième ion au site catalytique et se termine par la libération rapide du produit une fois la réaction réalisée. À ce stade, le MG2 + reste lié au site de conformation.
Dans le même sens, pour favoriser la réalisation de la réaction l'enzyme moyenne en premier lieu la génération d'un intermédiaire carbanion, éliminant un proton de carbone 2 du 2pga. Cela le fait grâce à l'action d'un résidu d'acide aminé de base.
Séquentiellement, l'élimination de l'hydroxyle du carbone 3 a lieu par l'action d'un résidu acide de l'enzyme. À ce stade, l'union des deux carbones est réalisée au moyen d'une double obligation formant PEP. De cette façon, la réaction est culminée.
Il peut vous servir: Royaume de Monera: caractéristiques, classification et exemplesLes fonctions
Jusqu'à présent, de nombreuses enzymes étudiées sont capables d'exécuter une grande variété de fonctions non liées à leur "fonction classique" dans différents compartiments cellulaires. Ces enzymes ont été appelées enzymes "au clair de lune".
En ce sens, l'énolase peut être considérée comme une enzyme au clair de lune, car de nombreuses fonctions opposées à leur fonction classique ont été attribuées à ce jour dans les bactéries et les eucaryotes.
Certaines de ces fonctions sont les suivantes:
- Participer au maintien de la forme cellulaire ainsi qu'au trafic vésiculaire lors de l'interaction avec les protéines du cytosquelette.
- Dans le noyau des cellules mammifères, agit comme un facteur de transcription qui régule l'expression des gènes associés à la prolifération cellulaire. Coopérer dans le maintien de la stabilité du RNM dans la dégradation des bactéries.
- Dans les agents pathogènes, comme Streptococcus pneumoniae et Trypanosoma cruzi, Il semble qu'il agit comme un facteur de virulence important.
- Il a également été constaté que dans Streptococcus pyogenes, L'énolase est excrétée sur le milieu extracellulaire facilitant la dégradation des tissus et l'évasion du système hôte.
- À la surface des cellules tumorales, il est exprimé en améliorant les métastases.
Énolase et sa relation avec les mécanismes de diffusion cellulaire
De nombreux agents pathogènes, ainsi que les cellules tumorales, expriment dans leur membrane ou excrétent les protéases moyennes extracellulaires capables de dégrader les protéines protéiques.
Cette capacité permet à ces cellules de percer les tissus et de se propager rapidement dans tout l'organisme hôte. Favorisant ainsi l'évasion du système immunitaire et, par conséquent, l'établissement de l'infection.
Même lorsque Enolasa n'a pas d'activité de protéase, participe au processus de diffusion de nombreux agents pathogènes dans son hôte ainsi que des cellules tumorales pendant le stastase de but.
Cela y parvient grâce au fait qu'il est exprimé à la surface de ces cellules fonctionnant comme un récepteur du plasminogène. Ce dernier est le zimogène d'une sérin-protéase connue sous le nom de plasmima qui fait partie du système fibrinolytique et agit dégrader les protéines matricielles extracellulaires.
Par conséquent, l'énolase exprimée à la surface est une stratégie que ces cellules ont acquise pour établir l'infection et se propager avec succès.
Il peut vous servir: Spéciation sympatrique: concept, caractéristiques et exemplesCette stratégie se compose de deux processus:
- L'évasion du système immunitaire de l'hôte. Puisque, lorsque ces cellules d'une protéine hôte sont enduites, elles sont ignorées par les cellules du système immunitaire qui reconnaissent les agents pathogènes non-bas associés aux agents pathogènes.
- Diffusion post-action du plasminogène dans le plasminate. Dont la participation à la dégradation des protéines matricielles extracellulaires facilite alors la diffusion rapide et efficace.
Les références
- Avilan L, Gualdron-Lopez M, Quiñones W, González-González L, Hannaert V, Michels Paa, Concepción JL. ÉNOLASE: Un acteur clé du métabolisme et un facteur de virulence probable des parasites trypanosomatides pour son utilisation comme cible thérapeutique. Recherche enzymatique. Vol 2011. Article ID932549, 14 pages.
- Bhowmick I, Kumar N, Sharma S, Coppens I, Jarori GK, Plasmodium falciparum éosoase: expression spécifique au stade et localisation sous-cellulaire. Journal du paludisme. 2009; 8 (1). Article 179.
- Jour I, Peshavaria M, Quinn GB, une horloge moléculaire différentielle dans l'évolution de l'isoprotéine enoase. Journal of Molecular Evolution. 1993; 36 (6): 599-601.
- de la Torre-Scuder E, Manzano-Román R, Pérez-Sánchez R, Silsles-Lucas M, Oleaga A. Clonage et caractérisation de l'énolaase isociée de la surface de la surface de la plasminogène à partir de Schistosoma bovis. Parasitologie vétérinaire. 2010; 173: 73-84.
- Dinovo EC, Boyer PD. Sondes isotopiques du mécanisme de réaction de l'énolase. Taux de change des isotopes initiaux et equibibium: effets d'isotopes primaires et secandaires. J Biol Chem. 1971; 246 (14): 4586-4593.
- Kaberdin VR, Lin-Chao S, démolir de nouveaux rôles pour les composants mineurs de l'E. Coli ARN dégradé. Biologie de l'ARN. 2009; 6 (4): 402-405.
- Keller A, Peltzer J, Carpentier G. Interactions d'Enolas. Biochimica et biophysica acta. 2007; 1770 (6): 919-926.
- Lung J, Liu KJ, Chang JY, Leu SJ, Shih NY. Le MBP-1 est codé efficacement par une transcription alternative du gène enri1 régulé par le gène de la protéine du protéasome. Journal FEBS. 2010; 277 (20): 4308-4321.
- Pancholi V. Α-énolase multifonctionnelle: son rôle dans les maladies. Sciences de la vie cellulaire et moléculaire. 2001; 58 (7): 902-920.
- Poyner RR, Cleland WW, Reed GH. Rôle des Ins métalliques dans la catalyse par énolase. Un mécanisme cinétique ordonné pour une seule enzyme de substrat. Biochimie. 2001; 40: 9008-8017.
- Segovia-Gamboa NC, Chávez-Munguía B, Medina-Flores A, Entamoeba invadens, Processus d'encystation et énolase. Parasitologie expérimentale. 2010; 125 (2): 63-69.
- Tanaka M, Sugisaki K, Nakashima K, commandant des niveaux d'ARNm traduisibles pour les isozymes enoase pendant le développement du muscle squelettique Chickn. Communications de recherche biochimique et biophysique. 1985; 133 (3): 868-872.

