Caractéristiques et exemples de liaison covalente polaire
- 2613
- 312
- Adam Mercier
UN Liaison covalente polaire C'est qui s'est formé entre deux éléments chimiques dont la différence d'électronégativité est substantielle, mais sans s'approcher d'un caractère purement ionique. Il s'agit donc d'une forte interaction intermédiaire entre les liaisons covalentes apolaires et les liaisons ioniques.
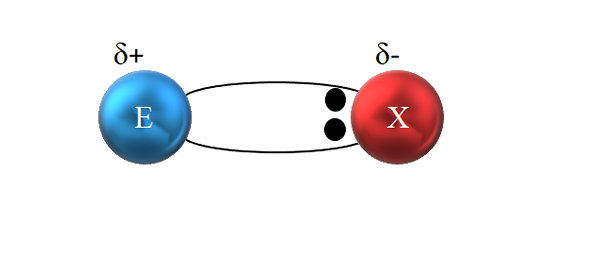
On dit qu'il est covalent car en théorie, il existe un partage équitable d'une paire électronique entre les deux atomes liés; c'est-à-dire que les deux électrons sont partagés également. L'atome E · donne un électron, tandis que · x fournit le deuxième électron pour former la liaison covalente E: X ou E-X.
 Dans une liaison covalente polaire, la paire d'électrons n'est pas partagée équitablement. Source: Gabriel Bolívar.
Dans une liaison covalente polaire, la paire d'électrons n'est pas partagée équitablement. Source: Gabriel Bolívar. Cependant, comme on le voit dans l'image supérieure, les deux électrons ne sont pas situés au centre de E et X, indiquant qu'ils "circulent" avec la même fréquence entre les deux atomes; mais sont plus proches de x que e. Cela signifie que X a attiré la paire d'électrons vers elle-même en raison de sa plus grande électronégativité.
Étant les électrons du lien plus près de x que e, autour de x une région de densité électronique élevée est créée, Δ-; Tandis que dans une région pauvre apparaît dans les électrons, Δ+. Par conséquent, il y a une polarisation des charges électriques: une liaison covalente polaire.
[TOC]
Caractéristiques
Degrés de polarité
Les obligations covalentes sont de nature très abondante. Ils sont pratiquement présents dans toutes les molécules hétérogènes et les composés chimiques; Depuis, après tout, il est formé lorsque deux atomes différents E et X sont liés. Cependant, il y a plus de liaisons covalentes polaires que d'autres, et pour découvrir que vous devez recourir à des électronégativités.
Quelle est la plus électronégative X, et moins électronégative E E (électropositive), alors la liaison covalente résultante sera plus polaire. Le mode conventionnel pour estimer cette polarité se fait par la formule:
Peut vous servir: borohydride de sodium (NABH4): structure, propriétés, utilisationsχX - χET
Où χ est l'électronégativité de chaque atome selon l'échelle Pauling.
Si cette soustraction ou soustraction a des valeurs comprises entre 0,5 et 2, alors ce sera un lien polaire. Par conséquent, il est possible de comparer le degré de polarité entre plusieurs liens E-X. Dans le cas où la valeur obtenue est supérieure à 2, il est question d'un lien ionique et+X- Et ce n'est pasδ+-Xδ-.
Cependant, la polarité de la liaison E-X n'est pas absolue, mais dépend des environnements moléculaires; C'est-à-dire dans une molécule -e-x-, où E et X forment des liaisons covalentes avec d'autres atomes, ce dernier influence directement ce degré de polarité.
Éléments chimiques qui les créent
Tandis que E et X peuvent être n'importe quel élément, tous ne procèdent pas de liaisons covalentes polaires. Par exemple, si E est un métal hautement électropositif, comme l'alcalin (Li, Na, K, Rb et Cs), et x a halogène (F, Cl, Br et I), ils auront tendance à former des composés ioniques (Na+CL-) et non les molécules (Na-Cl).
C'est pourquoi les liaisons covalentes polaires se trouvent généralement entre deux éléments non métalliques; et dans une moindre mesure, entre les éléments non métalliques et certains métaux de transition. Voir le bloc p À partir du tableau périodique, il existe de nombreuses options pour former ce type de liens chimiques.
Caractère polaire et ionique
Dans les grandes molécules, il n'est pas important de réfléchir à la polaire d'un lien; Ce sont très covalents, et la distribution de leurs charges électriques (où se trouvent les régions riches ou pauvres).
Peut vous servir: chromatographie en phase gazeuseCependant, avec des molécules diatomiques ou petites, cette polarité etδ+-Xδ- C'est assez relatif.
Ce n'est pas un problème avec les molécules formées entre les éléments non métalliques; Mais lorsque la transition ou les métaux métalloïdes participent, il n'y a plus seulement de parler d'une liaison covalente polaire, mais d'une liaison covalente avec un certain caractère ionique; et dans le cas des métaux de transition, d'un lien de coordination covalent étant donné la nature de la même.
Exemples de liaison covalente polaire
CO
La liaison covalente entre le carbone et l'oxygène est polaire, car la première est moins électronégative (χC = 2,55) que le second (χSOIT = 3,44). Par conséquent, lorsque nous voyons les liens C-O, C = O O C-O-, Nous saurons que ce sont des liens polaires.
H-X
Les halogénures d'hydrogène, HX, sont des exemples idéaux pour comprendre la liaison polaire dans leurs molécules diatomiques. Ayant une électronégativité hydrogène (χH = 2,2), nous pouvons estimer à quel point ces halogénuros sont polaires:
-HF (H-F), χF (3,98) - χH (2,2) = 1,78
-HCL (H-CL), χCL (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBR (2,96) - χH (2,2) = 0,76
-Hi (H-i), χToi (2.66) - χH (2,2) = 0,46
Notez que selon ces calculs, le lien H-F est le plus polaire de tous. Maintenant, quel est son caractère ionique exprimé en pourcentage, c'est un autre sujet. Ce résultat n'est pas surprenant car le fluor est l'élément le plus électronégatif de tous.
Lorsque l'électronégativité descend du chlore à l'iode, les liens H-Cl, H-BR et H-I deviennent moins polaires. Le lien H-I doit être apolaire, mais en réalité, il est polaire et aussi très "cassant"; se brise facilement.
Peut vous servir: Hydroxyde de mercure: structure, propriétés, utilisations, risquesOH
Le lien Polar O-H peut être le plus important de tous: grâce à lui, il y a la vie, car il collabore avec le moment dipolaire de l'eau. Si nous estimons la différence entre les électronégativités de l'oxygène et des hydrogènes, nous aurons:
χSOIT (3,44) - χH (2,2) = 1,24
Cependant, la molécule d'eau, H2Ou, il a deux de ces liens, H-O-H. Cela, ainsi que la géométrie angulaire de la molécule et son asymétrie, en font un composé très polaire.
N-H
La liaison N-H est présente dans les groupes amino de protéines. Répéter le même calcul que nous avons:
χN (3.04) - χH (2,2) = 0,84
Cela reflète que la liaison N-H est moins polaire que O-H (1,24) et F-H (1,78).
Laid
Le lien Fe-O est important car leurs oxydes se trouvent dans les minéraux de fer. Voyons s'il est plus polaire que H-O:
χSOIT (3,44) - χFoi (1,83) = 1,61
De là, on suppose à juste titre que le lien Fe-O est plus polaire que le lien H-O (1,24); Ou quel est la même chose que de dire: Fe-O a un plus grand caractère ionique que H-O.
Ces calculs servent à apparaître les degrés de polarité entre plusieurs liens; Mais ils ne suffisent pas pour régner si un composé est ionique, covalent ou son caractère ionique.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Laura Nappi. (2019). Liaisons covalentes polaires et non polaires: définitions et exemple. Étude. Récupéré de: étudier.com
- Helmestine, Anne Marie, Ph.D. (18 septembre 2019). Définition de la liaison polaire et exemple (liaison covalente polaire). Récupéré de: Thoughtco.com
- Elsevier B.V.(2019). Liaison covalente polaire. ScienceDirect. Récupéré de: ScienceDirect.com
- Wikipédia. (2019). Polarité chimique. Récupéré de: dans.Wikipédia.org
- Anonyme. (5 juin 2019). Propriétés des liaisons covalentes polaires. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- « Origine, caractéristiques, pièces, fonctions, types, types
- 80 raisons pour lesquelles je t'aime ou j'aime »

