Énergie d'ionisation
- 2068
- 177
- Paul Dumas
Qu'est-ce que l'énergie d'ionisation?
La énergie d'ionisation, Représenté par le symbole I, c'est la quantité minimale d'énergie requise pour démarrer l'électron externe à une taupe d'atomes à l'état gazeux, dans son état fondamental. En d'autres termes, c'est la quantité minimale d'énergie nécessaire pour transformer une mole d'atomes neutres en un état gazeux en une mole d'ions avec une charge positive (d'où son nom).
Vu sous la forme d'une équation chimique, l'énergie d'ionisation serait l'énergie requise pour le processus suivant:
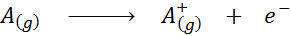
L'énergie d'ionisation est une mesure directe de la force des électrons les plus externes d'un élément chimique. Lors de la définition de l'énergie du processus d'ionisation de l'état gazeux, la contribution ou l'interférence des interactions intermoléculaires qui se produisent dans les états liquides et solides est évité.
De cette façon, il est assuré que l'énergie d'ionisation ne dépend que des forces internes de l'atome et, en particulier, de la stabilité des électrons qui forment la couche de valence de chaque élément.
Le processus de retrait d'un électron de la couche de valence est un processus qui nécessite de l'énergie, c'est donc un processus endothermique. Pour cette raison, les énergies d'ionisation sont toujours positives (par convention, lorsque l'énergie entre un système est considérée comme positive).
Il y a plus d'une énergie d'ionisation
Bien que la définition de l'énergie d'ionisation soit appliquée aux atomes neutres qui deviennent des ions positifs (c'est-à-dire des cations), il peut également être appliqué à l'élimination successive des électrons ioniques positifs, c'est-à-dire des espèces qui déjà ont déjà perdu des électrons.
En ce sens, l'énergie pour ioniser l'atome neutre ne devient que la première de nombreuses énergies d'ionisation possibles, car il y en a une pour chaque électron qui tourne autour du noyau.
Peut vous servir: quels sont les éléments du mouvement?En d'autres termes, les énergies associées à tous les processus suivants sont considérées comme des énergies d'ionisation:
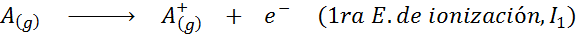
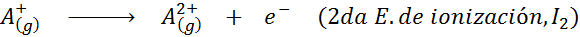
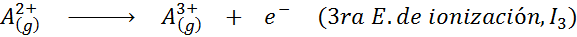
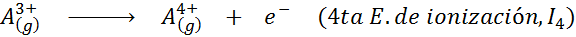
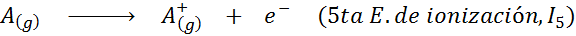
Ordre des énergies d'ionisation successives
Pour tout atome de n'importe quel élément, il est réalisé qu'une énergie d'ionisation sera toujours plus grande que toutes les énergies d'ionisation précédentes. En d'autres termes, les énergies d'ionisation successives ont la relation suivante:
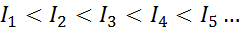
La raison pour laquelle cela se produit est très simple. La première énergie d'ionisation consiste à retirer un électron à un atome neutre. Cependant, la deuxième énergie d'ionisation implique de prendre un électron à un atome qui a déjà perdu le premier.
L'absence d'électrons laisse une charge nette positive qui attire avec plus de force les électrons restants, ils sont donc plus difficiles à commencer. De plus, cette absence réduit également l'effet du bouclier que les électrons ont sur les électrons les plus externes, de sorte que le noyau est capable de les attirer plus fortement.
Le résultat est qu'il est plus difficile de démarrer le deuxième électron que le premier, et il sera plus difficile de démarrer le troisième que le second, et ainsi de suite, comme on peut le voir dans la table d'énergie d'ionisation suivante pour les 10 premiers éléments du tableau périodique.
Z | Élément | Première | Deuxième | Troisième | Trimestre | Cinquième | Sixième |
1 | H | 1312 | |||||
2 | Il | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Être | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | SOIT | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
dix | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
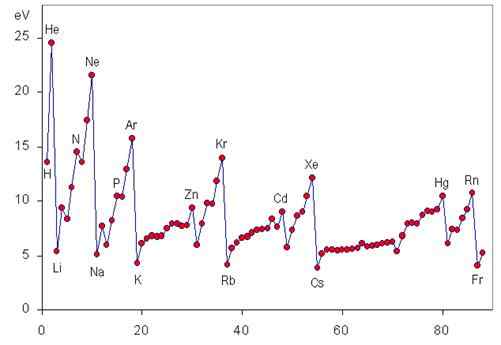
Tendance périodique de l'énergie d'ionisation
L'énergie d'ionisation est une propriété périodique qui augmente de gauche à droite et d'en bas au tableau périodique, comme on peut le voir dans les graphiques suivants.
Peut vous servir: Dilation linéaire: qu'est-ce que c'est, formule et coefficients, exemple
Variation de I sur une période
Lorsque nous nous déplaçons sur une période de gauche à droite, un peu appelé la charge nucléaire efficace est progressivement appelé, ce qui n'est rien de plus que la véritable charge positive que les électrons les plus externes peuvent "voir" en raison du bouclier des électrons les plus internes.
Cela signifie que la force avec laquelle le noyau est capable d'attirer les électrons de Valencia augmente, il devient donc plus difficile de les arracher et l'énergie requise (c'est-à-dire l'énergie d'ionisation) devient plus grande.
Variation de I tout au long d'un groupe
Lorsque vous descendant dans un groupe, nous plaçons des électrons dans l'augmentation des niveaux d'énergie et, par conséquent, dans les orbitales atomiques de plus en plus loin du noyau. Pour cette raison, la force avec laquelle le noyau attire des électrons de valence diminue à mesure que nous descendons en groupe, réduisant également l'énergie d'ionisation.
Comment déterminer l'énergie d'ionisation?
L'énergie d'ionisation est une certaine quantité expérimentale à travers une série de techniques appelées, ensemble, spectroscopie photoélectrons.
Ces techniques sont basées sur un phénomène très similaire à l'effet photoélectrique, dans lequel le rayonnement électromagnétique est capable de démarrer les électrons d'un atome, et la différence entre l'énergie du rayonnement et l'énergie cinétique avec laquelle l'électron est tiré représente l'énergie d'ionisation.
Les différentes techniques de spectroscopie photoélectrons permettent d'analyser les énergies dont pratiquement un électron est lié à son noyau, qu'il s'agisse d'un électron de valence ou d'un électron interne.
Exemples d'énergie d'ionisation
Énergies de première ionisation des gaz nobles
Les gaz nobles ont les configurations électroniques les plus stables de tous les éléments du tableau périodique. Pour cette raison, ils ont également les plus grandes énergies d'ionisation. La première énergie d'ionisation de chacun des gaz nobles est présentée ci-dessous:
-
Hélium
Sa première énergie d'ionisation est de 2373 kJ / mol, la plus élevée de tout le tableau périodique.
-
Néon
Sa première énergie d'ionisation est de 2080 kJ / mol et est la deuxième la plus élevée.
-
Argon
Sa première énergie d'ionisation est de 1521 kJ / mol. Seuls les F, NE et il ont de plus grandes énergies d'ionisation.
-
Kripton
La première énergie d'ionisation est de 1350 kJ / mol. Ce n'est pas aussi haut que les autres, mais il est encore plus grand que celui de ses éléments voisins.
-
Xénon
La même chose qui est dite du Kripton peut être dit du xénon avec sa première énergie d'ionisation de 1170 kJ / mol.
Peut vous servir: trou de ver: histoire, théorie, types, formationPremière et deuxième énergies d'ionisation des métaux alcalins
Les métaux alcalins ont à leur tour la moindre première énergie d'ionisation et la plus grande énergie d'ionisation de tous les éléments:
-
Lithium
Sa première énergie d'ionisation est inférieure à celle de celle du He, mais le lithium a la plus grande énergie d'ionisation de tous les éléments, qui est de 7300 kJ / mol.
-
Sodium
Le sodium perd son premier électron très facilement, car il acquiert la configuration électronique du NE, mais pour éliminer le deuxième électron, vous devez fournir 4560kj / mol.
-
Potassium
La première énergie d'ionisation en potassium n'est que de 418,7 kJ / mol, tandis que la seconde est de 3052 kJ / mol, considérablement supérieure à celle de ses voisins.
-
Rubidium
Avec une énergie d'ionisation de 403 kJ / mol, Rubidio est l'un des éléments avec moins d'énergie d'ionisation. Cependant, le second est 2633 kJ / mol.
-
Césium
Sa première énergie d'ionisation n'est que de 375 kJ / mol et la seconde 2234 kJ / mol, encore plus bas que la première énergie d'ionisation de l'hélium.

