Éléments, composés et mélanges
- 4700
- 1325
- Prof Ines Gaillard
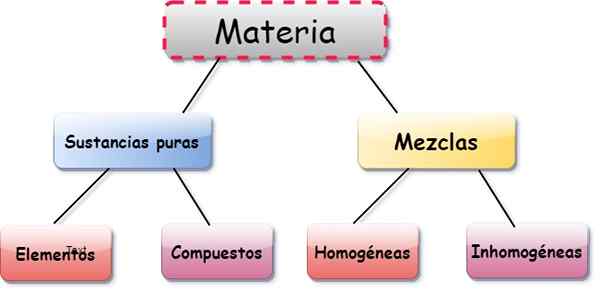
Les éléments, les composés et les mélanges sont trois formes de présentation de matière. Les articles Ce sont des substances constituées par une seule classe d'atome, le composés Ce sont des combinaisons entre deux ou plusieurs éléments, et mélanges Ils résultent de la composition de plusieurs éléments et substances.
Les composants des mélanges sont séparés par des moyens physiques. Pour sa part, pour séparer les éléments d'un composé, les procédures chimiques doivent être effectuées.
Il n'y a aucun moyen de les séparer en composants mineurs avec des méthodes ordinaires, mais il existe des moyens d'atomes de fissure. En fait, la fission est un moyen d'explorer de l'énergie.
Les atomes qui composent un certain composé le font toujours dans des proportions fixes. Pour sa part, dans un mélange, les proportions de ses composants peuvent varier. Par conséquent, les éléments et les composés sont considérés comme des substances pures, dont la composition est constante et bien définie.
Par exemple, la table du sel ou du chlorure de sodium est un composé dans lequel les atomes de chlore et de sodium participent, dans une proportion d'un par un. Pendant ce temps, le lait est un mélange de composition variable, dans laquelle chaque composant maintient son identité.
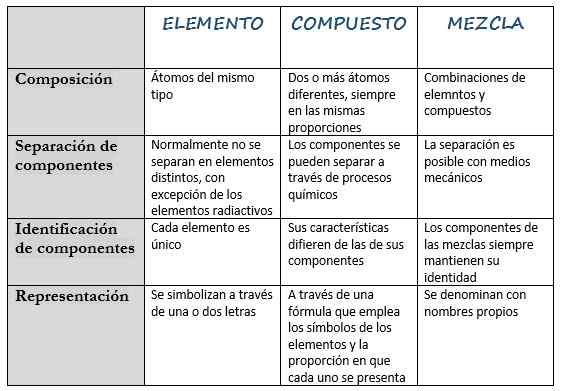
Le tableau suivant rassemble ses principales caractéristiques:
Élément | Composé | Mélanger | |
Définition | Substance qui ne peut pas être décomposée dans d'autres substances plus simples. | Substance constituée par deux ou plusieurs éléments différents. | Substance faite lors du mélange d'autres substances. |
Composition | Atomes du même type. | Deux atomes différents ou plus, toujours dans les mêmes proportions. | Combinaisons d'éléments et de composés. |
Séparation des composants | Normalement, ils ne se séparent pas en différents éléments, à l'exception des éléments radioactifs. | Les composants peuvent être séparés par des processus chimiques. | La séparation est possible avec des moyens mécaniques. |
Identification des composants | Chaque élément est unique. | Ses caractéristiques diffèrent de celles de ses composants. | Les composants des mélanges gardent toujours leur identité. |
Représentation | Ils sont symbolisés en une ou deux lettres. | À travers une formule qui utilise les symboles des éléments et la proportion dans laquelle chacun est présenté. | Il s'appelle avec des noms propres. |
Exemples | Hydrogène (h), silicium (oui), hélium (he), or (Au), potassium (k). | Chlorure de sodium (NaCl), ammoniac (NH3), hydrure de sodium (NAH), dioxyde d'azote (NO2). | Sang, lait, air, ciment. |
Articles
Définition
Les éléments sont des substances pures et simples, dans la composition duquel seuls les atomes du même type interviennent. Le comportement chimique de chaque élément est caractéristique et il n'y en a pas deux égaux, bien qu'il existe des caractéristiques communes entre les groupes d'éléments.
Peut vous servir: iodométrie: fondations, réactions, procédure générale, utilisationsIl n'est pas possible de décomposer un élément dans un élément plus simple, sauf pour des procédures spéciales, comme Bombard.
Le processus de désintégration se produit spontanément dans certaines substances telles que la radio, certaines variétés d'uranium, le thorium et d'autres éléments appelés radioactifs.
Composition
Les éléments sont formés par des atomes identiques. Ceux-ci, à leur tour, sont composés de trois types de particules: électrons, protons et neutrons. Les électrons et les protons ont respectivement une masse électrique, négative et positive. Les neutrons ont une masse, mais pas de chargement.
L'atome se compose d'un noyau atomique formé par des protons et des neutrons, tandis que les électrons sont distribués en orbitales autour d'eux. Un élément se distingue d'un autre par le nombre de protons que son noyau a, appelé numéro atomique.
Bien que cela reste constant, c'est le même élément, même si le nombre de neutrons et d'électrons change, car dans ce cas, le isotopes.
Identification des composants
Des techniques différentes et complexes sont utilisées, par exemple, pour «voir» les électrons de l'atome, il y a des microscopes spéciaux, tels que le microscope à effet tunnel.
Technique de séparation
L'atome d'un élément n'est pas séparé par des méthodes chimiques, mais est bombardé de particules plus petites, généralement des neutrons, dans un processus appelé fission nucléaire. Mais, bien qu'en théorie chaque atome soit physiquement, il est plus facile de le faire avec des atomes qui ont des noyaux lourds, comme l'uranium-235.
Types d'éléments
Il y a 118 éléments, situés dans le tableau périodique, commandé par numéro atomique. Parmi ceux-ci, 92 se trouvent dans la nature et les autres sont obtenus en laboratoire.
Peut vous servir: carbone amorphe: qu'est-ce que les types, les propriétés, les utilisationsIls sont distribués en trois groupes:
- Les métaux, avec des électrons libres qui en font de bons conducteurs de chaleur et d'électricité, presque toujours solides (sauf mercure) et haute densité.
- Aucun métal, manque de propriétés de conduite, n'est présenté à l'état solide ou gazeux, sauf le brome, et leur densité est plus faible.
- Métalloïdes, éléments avec des caractéristiques intermédiaires entre les métaux et les non-métaux.
Représentation graphique
Chaque élément du tableau périodique est symbolisé par des lettres. Par exemple, H, O, C et Fe correspondent respectivement à l'hydrogène, à l'oxygène, au carbone et au fer.
Exemples d'éléments
En plus de ceux mentionnés, il y a les éléments suivants, avec leur symbole entre parenthèses:
- Chlore (CL)
- Mercure (HG)
- Phosphore (p)
- Iode (i)
- Magnésium (mg)
Composés
Définition
Les composés sont des substances pures, dont la composition deux ou plusieurs types d'atomes différents est impliquée, dans certaines proportions, pour former des molécules. Les syndicats entre les atomes sont effectués par des liens, qui sont un facteur déterminant dans les propriétés composées.
Les liens principaux sont:
- Ionique
- Métal
- Covalent
Composition
Les composés se composent de deux types ou plus d'atomes, toujours en proportion fixe.
Identification des composants
Chaque composé a des propriétés qui la rendent unique, qui diffèrent de celles de ses éléments constitutifs, car ils perdent leur identité en formant le composé. Par exemple, à température ambiante, l'hydrogène et l'oxygène sont des gaz qui, lorsqu'ils sont combinés, donnent naissance à l'eau.
Technique de séparation
Les composés normalement sont séparés par des réactions chimiques, bien que le rayonnement électromagnétique, y compris la lumière, puisse également dissocier les molécules.
Types de composés
Les composés sont divisés en deux grandes catégories:
- Inorganique
- BIO
La différence est que les composés organiques sont basés sur l'élément de carbone, lorsqu'il forme des liens de type covalent avec l'hydrogène. Le carbone participe à la même manière dans de nombreux composés inorganiques, formant d'autres liens.
Représentation graphique
Il se fait par sa formule chimique, dans laquelle ses constituants sont spécifiés, avec leur symbole respectif et la proportion dans laquelle ils participent. Les composés ont également différents noms.
Exemples de composés
- Chlorure de sodium ou sel de table (NaCl)
- Bicarbonate de sodium (nahco₃)
- Ammoniac (NH3)
- Carbonate de calcium (CACO3)
- Glucose (c₆h₁₂o₆)
Mélanges
Définition
Combinaison de deux ou plusieurs éléments et / ou composés, sans proportions définies, chacune conservant leur identité, c'est-à-dire sans que leurs propriétés changent lorsqu'elles font partie du mélange.
Composition
C'est variable.
Identification des composants
Il est plus simple à réaliser, car les composants maintiennent leur identité.
Technique de séparation
Les composants d'un mélange peuvent être séparés par une méthode physique ou mécanique, comme le filtrage ou la centrifugation, par exemple.
Types de mélanges
Les mélanges sont classés comme:
- Homogène: les particules de composant sont indiscernables, bien qu'elles soient de substances différentes. Par exemple, du sucre très dissous dans l'eau.
- Hétérogène: mélanges dans lesquels les particules se distinguent, même à l'œil nu, comme le sable et le sel, ou le sel mélangé à des fichiers métalliques.
Représentation graphique
Les mélanges n'ont pas de formule définie, mais beaucoup ont leurs propres noms.
Exemples de mélanges
- Ciment
- Sauce tomate
- Bois
- Air
- Lait
- Béton
- Sang

