Clausius-Clapeyron Equation à quoi sert, exemples, exercices

- 3884
- 47
- Prof Noah Collet
La Équation de Clausius-Clapeyron C'est celui qui relie les changements dans la pression de vapeur et la température, dans une phase ou un changement de transition d'état. S'applique aux sublimations, aux évaporations, aux fusions ou même dans les changements dans les phases cristallines. Il convient de mentionner que cette équation s'applique à une substance pure qui est en équilibre.
Cette équation dérive des lois thermodynamiques et des diagrammes P-T pour une substance, où la ligne de coexistence est observée; Ce qui sépare deux phases différentes (vapeur liquide, solide-liquide, etc.). Pour transférer cette ligne, un gain ou une perte de chaleur est nécessaire, comme l'enthalpie de vaporisation, ΔHVapeur.
 Équation de Clausius-Clapeyron. Source: Gabriel Bolívar.
Équation de Clausius-Clapeyron. Source: Gabriel Bolívar. L'image supérieure montre l'équation Clausius-Clapeyron avant d'être intégrée. Normalement, il est généralement appliqué aux systèmes de vapeur liquide, où ΔH est utiliséVapeur et vous voulez calculer la pression de vapeur liquide à une certaine température. Il sert également à calculer le ΔHVapeur d'un certain liquide dans une plage de température.
L'équation de Clausisu-Clapeyron est également utilisée assez fréquemment pour étudier les changements de pression dans les solides volatils; c'est-à-dire que l'enthalpie de sublimation est considérée, ΔHsous.
[TOC]
Quelle est l'équation Clausisu-Clapeyron pour?
Calcul des pressions des pressions et des enthalpies de vaporisation
De l'équation de Clausius-Clapeyron d'en haut, certaines considérations mathématiques sont enfin faites pour enfin effectuer une intégration. Par exemple, pour un système de vapeur liquide, on suppose que ΔHVapeur Il ne varie pas avec la température, et que ΔV correspond exclusivement au volume de la vapeur, méprisant le volume du liquide (vfumer-Vliquide = Vfumer).
En supposant que la vapeur se comporte comme un gaz idéal et l'intégration, l'équation de Clausius-Clapeyron intégrée est obtenue:
Peut vous servir: volatilisation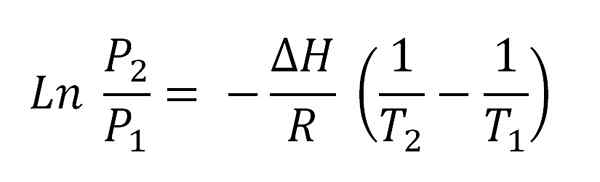 Équation Clausius-Clapeyron intégrée.
Équation Clausius-Clapeyron intégrée. Cette équation correspond à celle d'une ligne graphique comme:
Ln P vs 1 / T
Et dont la pente négative est (ΔH / R). Pour répondre à cette équation, par conséquent, ΔH doit être constant dans l'intervalle de température (t2-T1) dans lequel les pressions de vapeur sont mesurées en équilibre avec le liquide.
De cette façon, s'il est supposé que ΔH varie peu dans les petits intervalles de température, il est possible d'utiliser l'équation de cette ligne pour prédire les changements de la pression de vapeur d'un liquide; Et encore plus, vous pouvez déterminer son ΔH de vaporisation.
Plus les intervalles de températures sont considérables, plus l'écart de cette équation des données expérimentales est grande, et moins il sera rempli.
Détermination des changements de phase
Ainsi, l'équation de Clausius-Clapeyron devient le développement d'une ligne tangente à la ligne de coexistence entre deux phases physiques, qui est observée dans n'importe quel diagramme P-T pour une substance.
Si un changement de phase se produit, il y aura un changement sur la pente, et ΔH ne sera pas le même. Par conséquent, lorsque de forts écarts sont mis en évidence et que l'équation échoue, c'est un signe que dans l'intervalle de température, la substance connaît un autre changement de phase. C'est-à-dire qu'il cesse d'être un système de vapeur liquide, car il est transmis à la ligne de coexistence correspondant à l'équilibrage solide-liquide ou à vapeur solide.
Utiliser des exemples
- L'équation de Clausius-Clapeyron a été utilisée en météorologie pour étudier le comportement des nuages, même ceux présents sur d'autres planètes ou lunes avec des atmosphères.
Peut vous servir: acide gluconique: structure, propriétés, synthèse, utilisations- Il a été utilisé pour déterminer l'enthalpie de fusion de plusieurs métaux tels que le sodium et le gallium, et pour extrapoler leurs pressions de vapeur à des températures très élevées.
- Il a également été utilisé pour déterminer l'enthalpie de vaporisation de substances telles que le chlore gazeux, le tétrachlorure de carbone, l'eau liquide, la glace et l'iode.
- Il a également servi à étudier les changements de phase dans les structures cristallines. Dans ce dernier exemple, l'équation intégrée de Clausius-Clapeyron semble remarquablement différente, car les mêmes considérations qui sont prises pour le système de vapeur liquide ne peuvent pas être conçues pour ΔV. Les variations de volume d'une phase à l'autre cette fois sont petites.
Exercices résolus
- Exercice 1
La pression de vapeur de glace est 4.58 Torr à 0 ° C et 1.95 Torr A -10 ° C. Quelle est votre enthalpie de sublimation dans cette gamme de températures?
Notez que nous avons deux pressions et deux températures:
P1 = 4.58 Torr
P2 = 1.95 torr
T1 = 0 ° C + 273 = 273 K
T2 = -10 ° C + 273 = 263 K
Nous convertissons les unités de température de ° C en k, car la constante R des gaz a k dans ses unités:
R = 8.314 J / K
Ainsi, nous utilisons l'équation intégrée de Clausius-Clapeyron et Clear ΔHsous, qui resterait:
ΔHsous = -Rln (p2/ P1) / (1 / t2 - 1 / t1)
Pour plus de confort, se remplacera uniquement par les chiffres, mais sachant que la dernière unité sera la Joule:
ΔHsous = - (8.314) Ln (1.95/4.58) / (1/263 - 1/273)
= 50.97 J
Ou 51.07 J Considérant quelques décimales. Cette valeur présentera des oscillations en fonction des intervalles t2-T1 et de certaines pressions de vapeur.
- Exercice 2
Le point d'ébullition de l'éthanol à une pression de 760 Torr (1 atm) est de 78.3 ° C, et son enthalpie de vaporisation est 39.3 kJ. Quelle sera votre pression de vapeur à une température de 46 ° C?
Il peut vous servir: Tantale: Structure, propriétés, utilisations, obtentionNous identifions les données:
P1 = 760 torr
P2 = ?
T1 = 78.3 ° C + 273 = 351.3 K
T2 = 46 ° C + 273 = 319 K
ΔHVapeur = 39.3 kJ ou 39300 J
Donc, nous devons effacer P2 de l'équation intégrée de Clausius-Clapeyron. Encore une fois, les unités seront omises pour le confort et les calculs seront développés pas à pas:
Ln (p2/ P1) = - (ΔHVapeur/ R) (1 / t2 - 1 / t1)
Ln (p2/ 760) = - (39300/8.314) (1/319 - 1/351.3)
Ln (p2/ 760) = -1.36
Appliquer la fonction exponentielle des deux côtés de l'équation pour pouvoir effacer P2 nous aurons:
E (ln p2/ 760) = E(-1.36)
P2/ 760 = 0.256
P2 = 0.256 (760)
= 195 torr
À une température inférieure (46 ° C), la pression de vapeur inférieure (195 Torr). En fait, avoir l'éthanol une pression de 760 Torr à 78.3 ° C, nous parlons de son point d'ébullition normal. C'est le comportement attendu pour tous les liquides
En général, les exercices de Clausius-Clapeyron de ce type consistent à nettoyer P2, T2 ou ΔH de vaporisation ou de sublimation. Les calculs changent de manière significative lorsque ΔV doit également être pris en considération, en particulier en ce qui concerne les systèmes ou contrepoids solides.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2020). Relation clausius-clapeyron. Récupéré de: dans.Wikipédia.org
- Université d'État de San José. (s.F.). L'équation de Clausius-Clapeyron:
Dérivation et application des IST en météorologie. Récupéré de: sjsu.Édu - Groupe Bodner. (s.F.). L'équation Clausius-Clapeyron. Récupéré de: Chemed.Chem.Purger.Édu
- Chieh c. & Censul a. (18 mai 2020). Équation de Clausius-Clapeyron. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Walter J. Moore. (1962). Chimie physique. (Quatrième édition). Longmans.
- « 7 poèmes sur l'environnement des auteurs connus
- Apprentissage pour la théorie de la découverte, exemples, activités »

