Structure de sulfate de sodium (SDS) DoDecil, propriétés, utilisations
- 4242
- 983
- Raphaël Meyer
Il Dodécyl sulfate de sodium (SDS), est un sel organique anionique, synthétique et amphiphyllical. La partie apolaire et hydrophobe correspond à la chaîne d'hydrocarbures; Tandis que la partie polaire et hydrophile est due au sulfate, avec une charge négative.
Le SDS est un surfactant: ses molécules sont placées à la surface des solutions aqueuses, produisant une diminution de la tension de surface. Cette fonctionnalité permet son utilisation dans le shampooing, les crèmes dentaires, les savons et autres articles de soins personnels et le nettoyage à domicile.
 Structure du dodéle de sulfate de sodium. Source: Benjah-Bmm27 via Wikipedia.
Structure du dodéle de sulfate de sodium. Source: Benjah-Bmm27 via Wikipedia. Le dodécyle de sulfate de sodium se lie aux protéines et produit son déroulement, acquérant une forme allongée. Les groupes de sulfate sont exposés à l'eau, acquérant des protéines de charge négative, dont le nombre est proportionnel à leur poids moléculaire.
Pour cette raison, le SDS permet la détermination des poids moléculaires des protéines par électrophorèse dans le polyacrylamide.
Bien qu'un éventuel effet cancérigène du SDS ait été suspecté, il n'a pas été démontré de conclusion qu'il est ainsi. Les SD peuvent produire, comme d'autres détergents, la peau et l'irritation des yeux.
[TOC]
Structure SDS
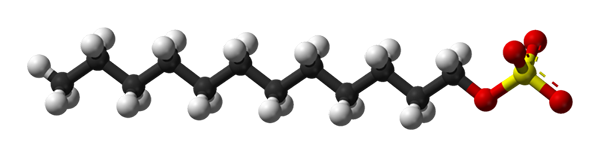
Dans la première image, la molécule SDS a été montrée avec un modèle de sphères et de barres. Comme on peut le voir, il a une queue de carbone hydrophobe et apolaire (sphères noires et blanches); Et en même temps, une tête polaire, grâce à la présence du groupe -So4- (sphères jaunes et rouges).
Bien qu'il ne soit pas montré, il devrait y avoir une sphère violette représentant le na cation+, Juste à côté du groupe -4-, interagissant électrostatiquement.
Cela dit, il est entendu à l'œil nu pourquoi ce composé est amphiphyllical; et aussi une tension anionique, car la charge du SDS est négative et peut attirer d'autres cations en plus du na+.
La molécule donne la fausse impression d'être rigide, une structure linéaire immobile. Cependant, c'est tout le contraire. Le SDS pourrait être comparé à un «ver», dont la queue de carbone présente plusieurs vibrations et rotations de ses liens simples. Cela le rend capable d'adopter différentes conformations ou plis au milieu; Dans l'eau, par exemple.
Cristaux
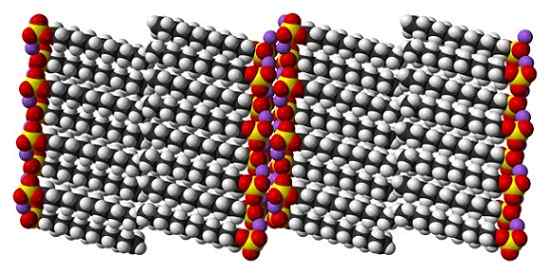 Structure cristalline du sulfate de sodium dodécyl. Source: Benjah-Bmm27 [domaine public]
Structure cristalline du sulfate de sodium dodécyl. Source: Benjah-Bmm27 [domaine public] S'il est vrai que le dodécyle de sulfate de sodium est une molécule dynamique, à l'état solide, il n'a pas besoin de se déplacer trop, se comportant comme une barre "simple". Et donc, chaque molécule ou barre est positionnée de telle manière que les interactions entre les files d'attente gazeuses et, en même temps, celles de leurs charges ioniques augmentent.
Peut vous servir: chlorite de sodium (Naclo2): structure, propriétés, utilisations, risquesLe résultat est la formation d'un cristal monoclinique, où les molécules SDS sont emballées dans plusieurs colonnes de bar (image supérieure). Les forces intermoléculaires qui les unissent sont telles que ces cristaux nécessitent une température de 206 ° C pour faire fondre la phase liquide.
Micelles
En dehors du confort de ses cristaux, la molécule SDS ne peut plus rester immobile; Commencez à tordre sa queue pour augmenter ou réduire les interactions avec l'environnement extérieur.
Si ce milieu est de l'eau, un phénomène appelé formation de micella se produit: le carbone et les queues hydrophobes se lient à s'entourer, tandis que les têtes polaires, les groupes -SO4-, Ils restent à la surface en interagissant avec les molécules H2SOIT.
Ensuite, la micella acquiert une morphologie ellipsoïde oblate (comme la Terre, mais plus écrasée). Dans le cristal, ils sont comme des blocs de barre et dans un milieu aqueux comme les micelles ellipsoïdes. Et si le milieu était de l'huile? Le myce serait investi: les têtes polaires donc4- Ils iraient au noyau, tandis que leurs queues gazéiquées seraient exposées à l'huile.
Propriétés
Des noms
- Dodécilfate de sodium (SDS).
- Laurilsulfate de sodium (SLS).
Formule moléculaire
C12H25SOIT4Sna.
Masse molaire
288 378 g / mol.
Description physique
Plusieurs présentations: poussière sèche, liquide ou solide humide. Ses cristaux ont une coloration blanche ou crémeuse.
Odeur
Père odeur de substances grasses, toilettes.
Point de fusion
206 ºC.
Solubilité dans l'eau
1 · 105 mg / l. 1 g dissous dans 10 ml d'une solution d'opalescent.
Densité
1,01 g / cm3.
La stabilité
Il est stable dans les conditions de stockage recommandées.
Décomposition
Lorsqu'il est chauffé à la décomposition émet une fumée blanche d'oxyde de soufre et d'oxyde de sodium.
Tension superficielle
39,5 dynas / cm à 25 ºC.
Concentration molaire critique
Est de 8,2 mm dans de l'eau pure à 25 ° C.
Applications
Soins personnels et nettoyage à la maison
Le dodécyle sulfate est un tensioactif utilisé dans de nombreux produits, tels que des savons de toilette, des bains en mousse, des crèmes de rasoir, etc. Il est également utilisé pour éliminer les taches de la difficulté à supprimer, dans le nettoyage des sols et des salles de bains, en fourrure des articles de la cuisine, etc.
Peut vous servir: huile ou éther de benzine: formule, structure, utilisationsMédecine vétérinaire et humaine
Il est utilisé comme répulsif des puces et des tiques, présents chez les animaux. Il est également utilisé comme hydratant dans certains antibiotiques, pour une utilisation orale ou topique.
Le SDS est un microbicide contre les virus avec emballage, comme le VIH, les types 1 et 2, et le virus de l'herpès simple de l'herpès (HSV-2). Il agit également sur le virus sans emballage: papillomavirus, réovirus, rotavirus et poliovirus. Cependant, cette utilisation n'est pas approuvée.
L'utilisation de SDS a été suggérée comme une douche vaginale qui fournit une protection contre le virus sexuellement transmissible. De plus, dans le traitement du lait maternel pour éliminer ou réduire la possibilité de transmission du VIH via l'allaitement.
En plus de son action antivirale, le SDS agit sur les bactéries pathogènes et les champignons. SDS élimine les facteurs de résistance aux médicaments et de résistance sexuelle de E. coli; et bloque la croissance de nombreuses bactéries à Gram positive.
Dans le laboratoire
Le SDS se lie aux protéines provoquant leur dénaturation, fournissant des charges négatives et un changement de conformation. Cela permet de déterminer ses poids moléculaires par électrophorèse dans le polyacrylamide.
SDS est également utilisé dans la préparation d'échantillons de tissus cérébraux à utiliser en microscopie optique. Il est également utilisé dans la préparation d'échantillons de sang pour le nombre d'érythrocytes.
Le SDS est utilisé dans la purification des acides nucléiques, en raison de leur capacité à dissoudre les membranes et à leur action inhibitrice sur l'activité des enzymes Arnasa et Dnaasa.
De plus, le SDS est utilisé dans la caractérisation des composés d'ammonium quaternaire.
Additif alimentaire
SDS est utilisé comme émulsifiant et épaississement de la nourriture. Améliore la stabilité et la texture des produits au four. De plus, il est utilisé comme auxiliaire dans les produits d'œufs séchés.
Peut vous servir: nitrate de zinc: structure, propriétés, obtention, utilisationsIndustrie
Le SDS est utilisé dans l'industrie de la galvanoplastie, en particulier le nickel et le zinc; comme émulsifiant et pénétrant le vernis et le dissolvant de la peinture; dans la formulation d'explosifs moulés par injection; Et dans des roquettes solides comme la moussage.
Des risques
Une exposition constante SDS peut provoquer une hyperplasie cutanée chez les cobayes. Le lapin et les êtres humains sont moins sensibles à ces blessures. Un contact direct avec SDS à une concentration ≤ 20%, peut provoquer une inflammation modérée et une irritation cutanée.
D'un autre côté, une exposition prolongée à SDS peut produire une dermatite, avec des signes de rougeur, de gonflement et de formation d'ampoules.
SDS peut produire par irritation des yeux de contact. Il peut également être très réactif chez certaines personnes et provoquer une irritation de l'inhalation des voies respiratoires et de la détresse respiratoire.
Rarement, l'ingestion de SDS peut provoquer des lésions caustiques. Mais, il a été rapporté chez les enfants qui ont ingéré SDS, des vomissements abondants du développement rapide, de la dépression du SNC et de la détresse respiratoire.
Aucune preuve de génotoxicité ou d'action tératogène n'a été trouvée dans le SDS. Chez 242 patients atteints de dermatite eczémateuse, 6,4% des patients allergiques ont été trouvés, attribuables à l'utilisation de SDS.
Les références
- Données structurelles de L. POUR. Smith, R. B. Hammond, k. J. Roberts, D. Machin, g. McLeod (2000). Détermination de la structure cristalline du dodécyl sulfate de sodium anhydre à l'aide d'une combinaison de techniciens de diffraction de la poudre de rayonnement sychrotron et de modélisation moléculaire. Journal of Molecular Structure 554 (2-3): 173-182. Doi: 10.1016 / S0022-2860 (00) 00666-9.
- Wikipédia. (2019). Dodécyl sulfate de sodium. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2019). Dodécyl sulfate de sodium. Base de données PubChem. CID = 3423265. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Hammouda B. (2013). Effet de température sur la nanostructure des micelles SDS dans l'eau. Journal of Research of the National Institute of Standards and Technology, 118, 151-167. Doi: 10.6028 / jres.118.008
- Elsevier. (2019). Dodécyl sulfate de sodium. Science directe. Récupéré de: ScienceDirect.com
- Kumar, s., Thejajenuo, j. K. et Tsipila, t. (2014). Effets toxicologiques du dodécyl sulfate de sodium. Journal of Chemical and Pharmaceutical Research 6 (5): 1488 - 1492.
- Réseau de données toxicologie. (s.F.). Sulfate de lauryle de sodium. Toxyt. Récupéré de: toxnet.NLM.NIH.Gouvernement
- « Structure tertiaire des principales caractéristiques Caractéristiques
- Structure de phosphatidillérine, synthèse, fonctions, emplacement »

