Structure de diméthylamine ((CH3) 2NH), propriétés, utilisations, risques
- 852
- 167
- Jade Duval
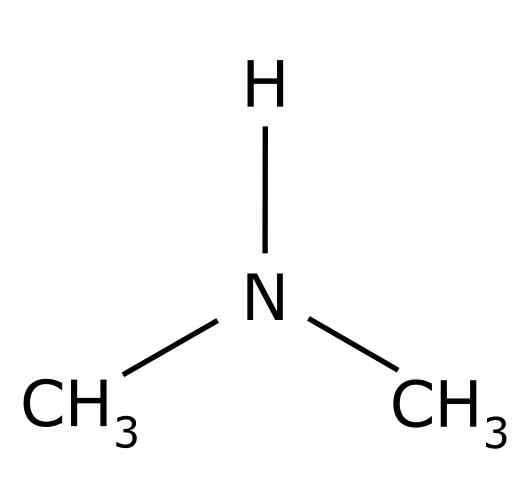
La diméthylamine C'est un composé organique formé par deux groupes méthyle -ch3 United à un groupe -nh. Sa formule chimique est (CHO3)2NH. C'est un gaz incolore. Lorsqu'une odeur de poisson est perçue dans l'air à faible concentration. Cependant, s'il est à haute concentration, il a une odeur d'ammoniac NH3.
La diméthylamine est présente dans les plantes et les animaux. On pense que dans l'être humain provient de la décomposition de certaines enzymes mais aussi de l'ingestion de certains aliments comme le poisson. Si le gaz de diméthylamine se dissout dans l'eau, il forme des solutions très alcalines et corrosives.
 Diméthylamine. Ring0 [domaine public]. Source: Wikimedia Commons.
Diméthylamine. Ring0 [domaine public]. Source: Wikimedia Commons. Il a diverses utilisations industrielles comme pour produire des solvants, pour accélérer la vulcanisation du caoutchouc.
La dimélamine est un gaz très inflammable. Les conteneurs qui le contiennent ne doivent pas être exposés à la chaleur ou au feu car ils peuvent exploiter. De plus, leurs vapeurs sont des yeux irritants, la peau et les voies respiratoires.
C'est un composé qui peut faire partie des aérosols atmosphériques, c'est-à-dire des gouttelettes très minces trouvées dans l'atmosphère.
[TOC]
Structure
La dimélamine est une amine aliphatique secondaire. Cela signifie que les substituants d'azote (N) sont aliphatiques (-ch3), ce qui signifie qu'ils ne sont pas aromatiques et qu'ils sont deux. Par conséquent, il y a deux méthyl -ch3 Azote américain, qui a également un hydrogène (H).
Dans la molécule de diméthylamine, l'azote (N) a une paire d'électrons libres, c'est-à-dire quelques électrons qui ne sont unis à aucun autre atome.
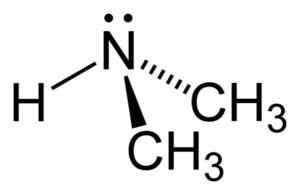 Structure de la diméthylamine. Auteur: Benjah-bmm27. Source: Wikimedia Commons.
Structure de la diméthylamine. Auteur: Benjah-bmm27. Source: Wikimedia Commons. Nomenclature
- Diméthylamine
- N, n-diméthylamine
- N-méthylmétanamine
- DMA (acronyme de di-méthyl-amine).
Propriétés
État physique
Gaz incolore.
Poids moléculaire
45,08 g / mol
Point de fusion
-93 ºC
Point d'ébullition
7.3 ºC
Point d'inflammation
-6,69 ºC (méthode de tasse fermée).
Température d'auto-direction
400 ° C
Peut vous servir: loi de plusieurs proportionsDensité
Liquide = 0,6804 g / cm3 A 0 ºC.
Vapeur = 1,6 (densité relative par rapport à l'air, air = 1).
Solubilité
Très soluble dans l'eau: 163 g / 100 g d'eau à 40 ° C. Soluble dans l'éthanol et l'éther éthylique.
pH
Les solutions aqueuses de diméthylamine sont fortement alcalines.
Constante de dissociation
Kb = 5,4 x 10-4
PAQUETpour d'acide conjugué = 10 732 à 25 ° C. L'acide conjugué est l'ion diméthylamonium: (CHO3) NH2+
Propriétés chimiques
La diméthylamine liquide peut attaquer certains plastiques, pneus et revêtements.
Lors de la dissolution dans l'eau, la paire d'électrons sans azote (N) prend un proton (H+) d'eau, laissant un oh libre-, Il forme donc des solutions très alcalines et corrosives:
Diméthylamine + eau → diméthylamonium ion + ion hydroxyle
(Ch3)2NH + H2O → (Choisissez3)2NH2+ + Oh-
Avec l'acide nitrique, un sel de nitrate est obtenu, c'est-à-dire du nitrate de diméthyla amotylamonium:
Diméthylamine + acide nitrique → Nitrate de diméthylamonium
(Ch3)2NH + HNO3 → (ch3)2NH2+NON3-
Autres propriétés
En cas de faible concentration d'air a une odeur similaire aux poissons, tandis qu'à des concentrations élevées, il sent l'ammoniac (NH3).
Réactions biochimiques
Dans l'organisme, la diméthylamine peut souffrir de nitrillaire dans des conditions faiblement acides pour donner à la diméthylnitrosamine un composé cancérogène (ch3)2N-no.
La formation de dimemetlnitrosamine se produit à partir de diméthylamine et de nitrite (nitrite de sodium) dans l'estomac (un pH 5-6) par action des bactéries existant dans le tractus gastro-intestinal. Le nitrite de sodium est présent dans certains aliments.
Diméthylamine + nitrite de sodium → diméthylnitrosamine + hydroxyde de sodium
(Ch3)2NH + nano2 → (ch3)2N-NO + Naoh
Obtention
La dimetilamine est préparée commercialement en réagissant au méthanol (choisissez3Oh) avec de l'ammoniac (NH3) à 350-450 ° C en présence d'un catalyseur de silice-alumine (SIO2/Au2SOIT3).
2 ch3OH + NH3 → (ch3)2NH + 2 h2SOIT
Étant donné que la monométhylamine et la triméthylamine sont également produites, une purification est réalisée dans une série de quatre à cinq colonnes de distillation.
Présence dans la nature
La diméthylamine se trouve dans les plantes et les animaux. Il est également présent naturellement et abondamment dans l'urine humaine.
Il peut vous servir: époxyde: nomenclature, obtention, applications, exemplesOn estime que sa présence chez l'homme est due au fait que certains types de bactéries intestinales sont produites à partir de certains composés trouvés dans les aliments.
Certains de ces composés sont la colline (composé qui est associé au groupe B de vitamines B) et à l'oxyde de triméthylamine. On pense également qu'il provient d'un inhibiteur enzymatique de l'oxyde nitrique (NO) qui se forme dans le corps.
Certaines sources d'informations indiquent que l'augmentation de la diméthylamine dans l'urine est causée par l'ingestion de poissons et de fruits de la mer, où des valeurs majeures sont obtenues lorsqu'elles mangent des calmars, des hake, des sardines, de l'espadon, de la morue, du poisson et de la ligne.
 Manger du poisson pourrait augmenter les niveaux de diméthylamine dans l'urine. Auteur: Anna Sulencha. Source: Pixabay.
Manger du poisson pourrait augmenter les niveaux de diméthylamine dans l'urine. Auteur: Anna Sulencha. Source: Pixabay. Patients atteints de diméthylamine excès
Il est considéré que la diméthylamine est une toxine urémique, c'est-à-dire une substance qui peut causer des dommages si sa concentration dans l'urine est augmentée. En fait, des niveaux très élevés de diméthylamine ont été observés chez les patients atteints d'une maladie rénale au stade terminal.
On pense que chez ces patients, il peut y avoir une surpopulation de bactéries intestinales qui pourraient la produire.
Applications
DMA ou DMA est utilisé pour:
- Préparation d'autres composés.
- Production de solvants de diméthylformamide et de diméthylacétamide.
- Accélérer la vulcanisation de certaines gencives.
- Éliminez les poils pendant le bronzage.
- Agir comme un antioxydant pour les solvants.
- Servir d'agent de flottation minérale.
- Inhiber la corrosion et en tant qu'agent anti-sniff.
- Fonctionner comme un surfactant.
- Faire des savons et des détergents.
- Agir comme chimiste dans les textiles.
- Fonctionne comme un agent anti-datation dans les carburants et comme un stabilisateur de gaz.
- Préparer les colorants.
- Absorber les gaz acides.
- Servir de pesticides et de fusées.
- Faire partie des agents du traitement de l'eau.
- Agir comme un fongicide dans les produits agrochimiques.
- Des utilisations déjà abandonnées comme attirer et exterminer les gorgjos ou les insectes qui attaquent le coton.
 Coton. Auteur: Isaa KC. Source: Pixabay.
Coton. Auteur: Isaa KC. Source: Pixabay.  Dans le passé, les insectes qui attaquent les plants de coton ont été éliminés avec de la diméthylamine. Marvinbikolano [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Dans le passé, les insectes qui attaquent les plants de coton ont été éliminés avec de la diméthylamine. Marvinbikolano [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Des risques
Les vapeurs de dimélamine sont une peau irritante, des yeux et des voies respiratoires.
Peut vous servir: composés inorganiquesSi vous entrez en contact avec la peau sous forme liquide, peut provoquer un gel et une brûlure chimique. Son inhalation a des effets néfastes sur la santé.
Le gaz DMA est corrosif et peut former des solutions aqueuses corrosives. Vos solutions aqueuses peuvent devenir inflammables à moins qu'elles ne soient assez diluées.
La diméthylamine en forme de gaz est facilement enflammée en produisant des fumées toxiques d'oxydes d'azote (nonX).
Si le récipient contenant ce gaz est exposé à une chaleur ou à la chaleur intense, il peut exploser.
Influence du DMA dans l'atmosphère
L'aérosol atmosphérique (très petites gouttelettes de mélange de composés naturels et / ou de polluants dans l'atmosphère) a un impact profond sur le climat mondial et la qualité de l'air dans les différentes régions du monde.
La formation de nouvelles particules d'aérosol n'est pas encore entièrement comprise.
On estime que la diméthylamine participe avec d'autres composés à la formation de ces particules, qui semble dépendre de la zone de fortes émissions de DMA.
Par exemple, dans les zones industrielles, il y a une plus grande concentration que dans les zones agricoles, ce qui peut influencer la façon dont le DMA participe.
Il convient de noter que, selon certains scientifiques, la combustion du matériel végétal contenant du glyphosate (l'un des herbicides le plus utilisé dans le monde) peut conduire à la formation de diméthylamine.
 Aérosols atmosphériques sur l'Amérique du Sud. La dimélamine pourrait contribuer à sa formation. Marvinbikolano [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Aérosols atmosphériques sur l'Amérique du Sud. La dimélamine pourrait contribuer à sa formation. Marvinbikolano [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Diméthylamine. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Quatrième édition. John Wiley & Sons.
- Morrison, R.T. Et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.
- Windholz, M. et al. (éditeurs) (1983). L'indice Merck. Une enyclopédie des produits chimiques, des médicaments et des biologiques. Dixième édition. Merck & Co., Inc.
- Abramowitz, m.K. et al. (2010). La physiopathologie de l'urémie. Amines aliphatiques. Dans la maladie rénale chronique, la dialyse et la transplantation (troisième édition). Récupéré de ScienceDirect.com.
- Li, H. et al. (2019). Influence des conditions atmosphériques sur la formation de particules à base d'acide sulfurique-acide-diméthylamine-Ammonia-Ammonia. Chosphère 2019; 245: 125554. NCBI a récupéré.NLM.NIH.Gouvernement.
- Mackie, J.C. et Kennedy, et.M. (2019). Pyrolyse du glyphosate et des chansons Produits toxiques. Environnement. SCI. Technol. 2019: 53 (23): 13742-13747. NCBI a récupéré.NLM.NIH.Gouvernement.
- « Biographie, style et œuvres de Jorge Edwards
- Coordonnées sphériques Exemples et exercices résolus »

