Structure de dihydroxyacétone, propriétés, obtention, utilisations
- 666
- 42
- Prof Ines Gaillard
La Dihydroxyacétone C'est un saccharide ou un sucre qui se compose du kétose le plus simple de tous, et dont la formule moléculaire est C3H6SOIT3. C'est donc un isomère structurel de la glycéraldéhyde, pouvoir être considéré comme une version oxydée de la glycérine. Son nom est abrégé avec les lettres DHA, à la fois en anglais et en espagnol, le connaissant également avec les noms 1,3-dihydroxyacétone, la glycéone ou 1,3-dihydroxi-2-propanone.
Contrairement à d'autres sucres, le DHA manque de carbones asymétriques, il n'a donc pas de configuration D ou L ou ne présente pas une activité optique; c'est-à-dire que vous ne pouvez pas détourner la lumière polarisée. Ce qu'il partage en commun avec les sucres, être un zea, c'est un goût sucré caractéristique et une excellente solubilité dans l'eau.
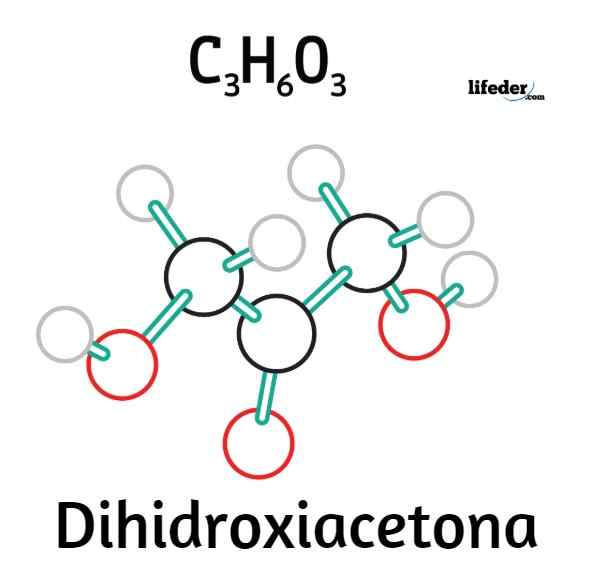
 Formule structurelle de la dihydroxyacétone
Formule structurelle de la dihydroxyacétone Dans l'image supérieure, nous avons la formule structurelle de la dihydroxyacétone. Groupe C = o Central est la raison pour laquelle le DHA est un kettose.
Le DHA est capable de réagir avec les groupes amineiques des kératines qui composent la surface la plus à l'extérieur de notre peau, appelée Stratum Corneum, produisant des pigments de tonalités oranges qui finissent par donner l'apparence d'un bronzage naturel. C'est pourquoi le DHA est utilisé comme ingrédient actif dans les produits de bronze sans soleil.
[TOC]
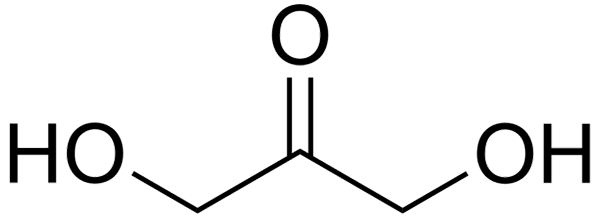
Structure

Dans l'image supérieure, nous avons la structure d'une molécule DHA représentée avec un modèle de sphères et de barres. Comme on peut le voir, les sphères rouges correspondent aux atomes d'oxygène. Sa géométrie est presque plate, car les groupes OH et H se distinguent légèrement de l'avion formé par les trois atomes de carbone et l'atome d'oxygène carbonyle.
 Structure moléculaire de la dihydroxyacétone. Source: Jynto / CC0
Structure moléculaire de la dihydroxyacétone. Source: Jynto / CC0 La molécule de DHA est assez polaire. Les groupes C = O et C-OH laissent une densité électronique élevée, tandis que leur squelette de carbone est de mauvais électrons.
Peut vous servir: acétophénoneSes interactions intermoléculaires sont donc basées sur les forces dipol-dipolo, en particulier celles des ponts d'hydrogène. Tout cela contribue au DHA est un solide cristallin dans des conditions normales.
Propriétés de la dihydroxyacétone
Apparence physique
Solide cristallin coloré, avec une odeur et une saveur sucrées et caractéristiques. Il est très hygroscopique, il absorbe donc l'humidité de l'environnement.
Masse molaire
90.078 g / mol
Point de fusion
89 à 91 ºC. Cette valeur imprécise est due au fait que toutes les molécules DHA ne sont pas à l'état expliqué, mais que la grande majorité d'entre eux forment des crépuscules.
Point d'ébullition
Indéterminé, car il se décompose.
Solubilité
Il est très soluble dans l'eau, ayant une solubilité approximative de 930 kg / L à 25 ºC. Cela est dû à son caractère très polaire et à la capacité de l'eau à l'hydrater en formant des ponts d'hydrogène avec l'un des trois atomes d'oxygène de sa molécule. Cependant, il se dissout lentement dans un mélange de stanol d'eau 1:15.
Hydrolyse et dissolution
À l'état solide, le DHA a tendance à exister en tant que domer. La transformation serait celle ci-dessous:
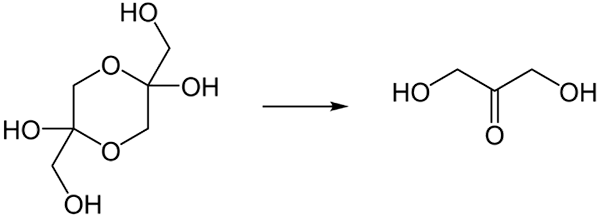 Conversion du dimère du DHA en monomère lorsqu'il est dissous dans l'eau. Source: Steffen 962 au Wikipedia allemand / domaine public
Conversion du dimère du DHA en monomère lorsqu'il est dissous dans l'eau. Source: Steffen 962 au Wikipedia allemand / domaine public Être le DHA dans sa forme monomère très hygroscopique, rapidement lorsqu'il séchait et absorbait l'humidité revient à l'établissement du dimère avec son anneau de dioxane.
Obtention et synthèse
Naturellement, le DHA peut être obtenu en l'extrait à partir de roseaux de sucre ou de betteraves à sucre.
D'un autre côté, lorsqu'il s'agit de le synthétiser ou de le produire, il existe plusieurs alternatives, toutes basées sur la réaction d'oxydation de la glycérine. L'un d'eux est d'oxyder la glycérine ou le glycérol avec du peroxyde d'hydrogène à l'aide de sels ferreux tels que des catalyseurs. Dans une autre réaction, la glycérine avec de l'air, de l'oxygène ou de la benzoquinone oxyde mais en utilisant des catalyseurs spéciaux de paladium.
Peut vous servir: Modèle atomique de Perrin: caractéristiques, postulatesNous avons également la méthode de production commerciale du DHA, dans laquelle la glycérine est oxydée à l'aide de bactéries acides acétiques dans un processus de fermentation.
Pendant la synthèse du DHA, il y a aussi du glycéraldéhyde, son isomère structurel.
Des risques
Les risques autour du DHA ne sont pas entièrement clairs. Dans sa forme phosphatée, le phosphate de dihydroxyacétone, c'est un produit de la glycolyse et un intermédiaire dans le métabolisme du fructose, car l'enzyme triosophosphate isomérase le transforme en D-glycéraldéhyde 3-phosphate. Cependant, une dose excessive de DHA, selon des études médicales, peut modifier négativement tout ce mécanisme, provoquant même la mort cellulaire.
C'est pourquoi le DHA est considéré comme dangereux s'il est ingéré ou si, surtout, il est inhalé. En plus de cela, il existe des études qui confirment que leurs applications topiques augmentent la concentration d'espèces réactives oxygénées (ROS), qui attaquent les cellules cutanées produisant leur vieillissement et l'apparition des rides.
Cette réaction collatérale semble encore plus accentuée lorsque la peau imprégnée de DHA est exposée aux rayons UV du soleil, de sorte que les risques de dommage à la peau augmentent.
Les experts recommandent donc de ne pas utiliser DHA dans des espaces extérieurs immédiatement après l'application des lotions de bronzage sur la peau.
Pour réduire ce risque, les lotions contiennent des additifs tels que les huiles végétales et antioxydantes, en plus des microcapsules qui libèrent progressivement le DHA.
La dihydroxyacétone utilise
 Les lotions bronzées contenant du DHA sont une option plus sûre lorsque la peau bronche sans s'exposer aux rayons du soleil
Les lotions bronzées contenant du DHA sont une option plus sûre lorsque la peau bronche sans s'exposer aux rayons du soleil La dihydroxyacétone est synonyme de cosmétiques, car il s'agit de l'ingrédient actif de nombreux produits de bronzage, des crèmes, des sorties, des masques, des lotions, etc. Lors de l'application de ces bronzeurs sur la peau se produit la réaction de Mailrd, responsable de cela, il acquiert une couleur plus orange, sans visiter la plage ni s'exposer à de longues heures sous le soleil du matin.
Il peut vous servir: impénétrabilité chimiqueAu début, en 1960, le bronzage était exagérément orange, à un point tel que pendant des décennies, le grand public a rejeté ce type de tanneur. Cependant, depuis lors, les formulations s'amélioraient, de sorte que le bronzé avait l'air plus naturel, rayonnant et agréable à la vue, tout en garantissant des risques plus bas après leurs utilisations.
Diverses marques, y compris Coco Channel, ont diminué les concentrations de DHA à un maximum de 20%, les incorporant également, un autre sucre qui réagit également avec les protéines cutanées et les composants qui neutralisent les effets des rayons UV. Ils ont également cherché à prolonger la durabilité du bronzage après l'application.
De nos jours, de nouveaux produits de bronzage arrivent sur le marché, qui resteront en plein essor jusqu'à ce que les études médicales certifient que le Tan n'utilise pas les risques possibles de l'application topique du DHA, qui est censé être capable de s'absorber dans les couches les plus profondes de la peau.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Cyriminna, R., Fidalgo, un., Ilharco, L. M., & Pagliaro, m. (2018). Dihydroxyacétone: un aperçu mis à jour d'un bioproducteur important. CHIMIRTHINE, 7(3), 233-236. est ce que je.org / 10.1002 / ouvert.201700201
- Wikipédia. (2020). Dihydroxyacétone. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Dihydroxyacétone. PubChem Comunund Résumé pour CID 670. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Mary Gallagher. (2018). Exposition à la dihydroxyacétone dans les produits de bronzage sans soleil comprenant les risques. Association des infirmières en dermatologie. Doi: 10.1097 / JDN.0000000000000366

