Structure d'isopréno, propriétés, applications
- 2786
- 149
- Prof Noah Collet
Il Isoprène ou 2-méthyl-1,3-butadiène, c'est un composé organique qui se compose d'un hydrocarbure dont la formule moléculaire est C5H8. Malgré sa simplicité apparente, il représente la base structurelle du caoutchouc naturel et, plus important encore, le squelette des unités biologiques avec lesquelles les isoprénoïdes ou les terpènes sont synthétisés enzymatiquement.
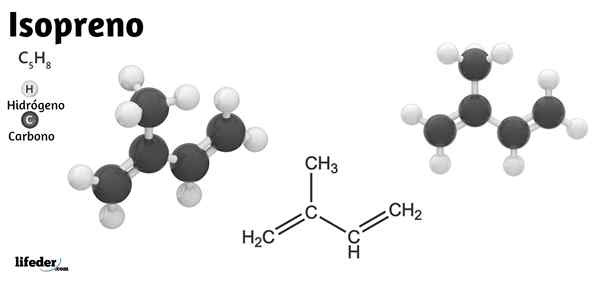
Par conséquent, l'isoprène prend de l'importance non seulement dans la chimie organique mais aussi en biochimie. Dans l'image inférieure, sa formule structurelle peut être vue, qui peut être décomposée linéairement comme Cho2= C (ch3) −ch = cho2. De cette formule, il est compris pourquoi son nom IUPAC est 2-méthyl-1,3-butadiène, car les deux doubles liaisons sont situées dans les carbones 1 et 3.
L'isoprène est un hydrocarbure considérablement courant dans l'environnement. Les plantes, les algues, les bactéries et les animaux sont capables de synthétiser et de l'émettre, formant même la partie la plus abondante de nos exhalations. Les masses végétales sont les principaux producteurs et émetteurs d'isoprène, l'utilisant dans des mécanismes pour résister à la chaleur extérieure.
Biochimiquement, l'isoprène dans son unité biologique est utilisé par les organismes pour synthétiser divers types de terpènes, parmi lesquels les laveurs et les composants des huiles essentielles se distinguent. Organisé, il sert à la synthèse de caoutchoucs synthétiques et d'autres polymères connexes.
[TOC]
Structure isoprène
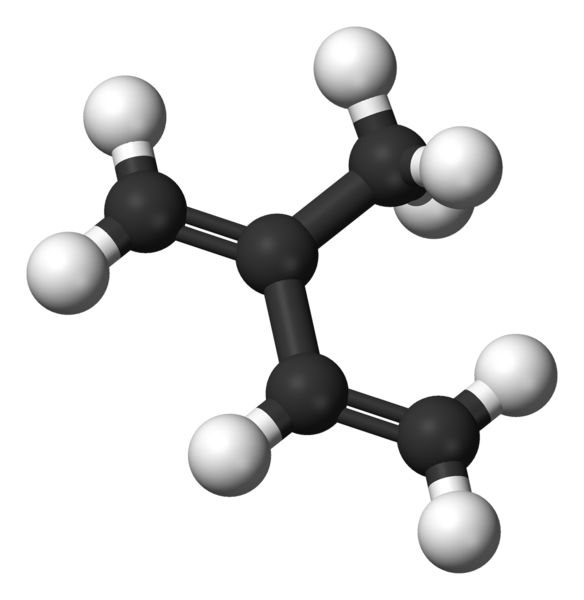 Molécule isoprène représentée par un modèle de sphères et de barres
Molécule isoprène représentée par un modèle de sphères et de barres Dans l'image supérieure, nous avons la structure moléculaire de l'isoprène. Comme on le voit, les sphères noires correspondent aux atomes de carbone, tandis que les blancs sont des atomes d'hydrogène.
La molécule présente une géométrie plate, c'est-à-dire que tous ses atomes sont disposés dans le même plan, à l'exception des hydrogènes du groupe -ch3 lié au carbone 2. Cette géométrie est due au fait que les atomes de carbone du squelette 1,3-butadiène ont une hybracie SP2, Alors que le carbone de -ch3 Il a sp3.
Peut vous servir: Bromine: historique, structure, configuration électronique, propriétés, utilisationsLes molécules d'isoprène interagissent entre elles par le biais des forces dispersives de Londres, qui sont considérablement faibles en raison de leurs masses moléculaires faibles. Cependant, ils exercent une cohésion suffisante pour que l'isoprène existe comme un liquide volatil dans des conditions normales.
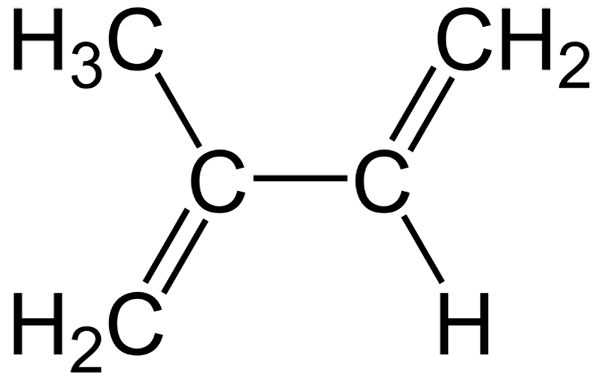 Formule structurelle de l'isoprène
Formule structurelle de l'isoprène Le fait que leurs molécules soient plates facilitent leur insertion entre les membranes cellulaires, contribuant à leurs renforts dans le mécanisme que les plantes utilisent pour amortir des changements de température soudains (40 ° C ou plus).
Les molécules d'isoprène sont capables de former des cristaux. Mais cela ne se produit pas de la même manière avec leurs polymères, le polyaprene, qui a tendance à se regrouper dans des solides amorphes, dont les masses moléculaires moyennes sont beaucoup plus grandes, cessent une substance volatile.
Propriétés isoprène
Les propriétés mentionnées ici correspondent à celles de l'isoprène et non à celles du caoutchouc naturel, qui se compose du polymère cis-1,4-polisoprène. Certaines sources bibliographiques peuvent même utiliser les propriétés du latex fraîchement extrait des arbres pour caractériser l'isoprène, étant une grave erreur pour les confondre.
Apparence
Liquide incolore et volatil avec une odeur similaire à l'huile.
Masse molaire
68.12 g / mol
Point de fusion
-143.95 ºC
Point d'ébullition
3. 4.067 ºC. Par conséquent, c'est un liquide assez volatil.
point de rupture
-54 ºC (tasse fermée)
Température d'auto-direction
395 ºC
Densité
0.681 g / cm3
Densité de vapeur
2.35 par rapport à l'air.
La pression de vapeur
550 mmHg à 25 ° C, ce qui est conforme à sa grande volatilité.
Solubilité
Être un hydrocarbure est inscriptif avec l'eau, situé dans ses mélanges au-dessus de cela car il est moins dense. Cependant, il est miscible avec l'acétone, le benzène, l'éther pétrolier, le disulfure de carbone, le dichlorométhane et pratiquement avec tout autre solvant aromatique ou chloré.
Peut vous servir: type de lien de 02Tension superficielle
16.9 DINS / CM.
Réactivité
L'isoprène peut réagir nucléophile (attaqué par des espèces riches en électrons) à travers leurs carbones 1 et 4. Ainsi, aux extrémités de son squelette de carbone, il peut être du polymère, qui donne naissance au polyaprene. Cette réaction de polymérisation est exothermique, à un point tel qu'en contact avec certaines substances, il peut devenir explosif.
Unités biologiques
L'isoprène, bien que intrinsèquement présent dans les structures des terpènes, n'est pas le matériau de départ utilisé par les enzymes pour les synthétiser. Au lieu de cela, ils utilisent des produits métaboliques appelés isopetenyl (IPP, bleu) et des produits pyrophosphate de diméthylil (DMApp, rouge) comme substrats (DMApp, rouge).
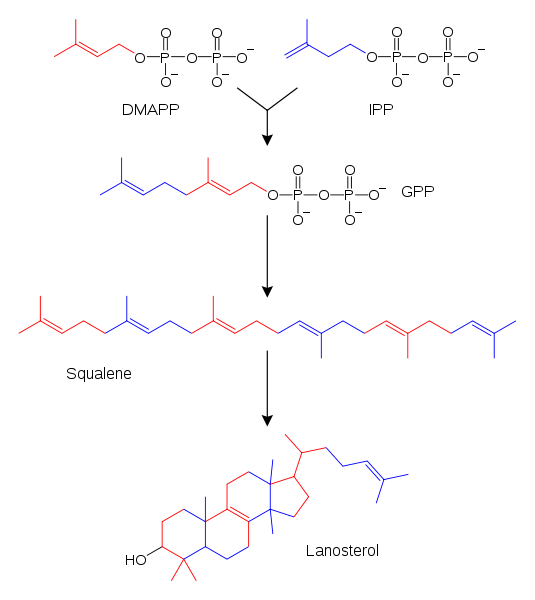 Synthèse du loosterol à partir des unités biologiques de l'isoprène. Source: fvasconcellos, original de Tim Vickers / Domaine public
Synthèse du loosterol à partir des unités biologiques de l'isoprène. Source: fvasconcellos, original de Tim Vickers / Domaine public Dans l'image supérieure, un exemple de la susmention ci-dessus. Les deux, l'IPP et le DMAPP, réagissent les uns avec les autres grâce à l'intervention enzymatique pour provoquer le geranilo pyrophosphate (GPP).
Ce dernier, à son tour, intègre d'autres fragments moléculaires de l'IPP ou du DMApp (voir couleurs), jusqu'à ce qu'il devienne l'Escualnene, un précieux précurseur pour la synthèse de la laine.
Ensuite, l'isoprène dans son unité biologique (IPP ou DMApp) participe à la biosynthèse des stérols et d'autres lipides. Nous avons également des terpènes, tels que le limonène (des huiles de citron et d'orange) et du miirceno (huile Arrayán), qui constituent des huiles essentielles, et qui sont synthétisées par des processus chimiques et structurellement similaire similaire.
En ce sens, l'unité isoprène, parfois clairement reconnaissable dans les terpènes ou les isoprénoïdes, est essentielle pour la synthèse des symphines de produits naturels.
Peut vous servir: alliageApplications isoprène
 L'une des principales applications en caoutchouc isoprène est la production de pneus de voiture
L'une des principales applications en caoutchouc isoprène est la production de pneus de voiture L'isoprène est polymérisé en caoutchouc naturel, de sorte que toutes ses applications peuvent être attribuées à ce composé de manière indirecte. Il fait partie du gutapercha, matériau élastique fait avec un mélange de cis et de polymères trans 1,4 polisopren, qui autrefois utilisés pour la fabrication de balles de golf.
Le caoutchouc sert à l'élaboration des balles, des tuyaux, des gants, des préservatifs, des bottes, des accessoires d'instruments électriques, des adhésifs, des costumes de plongée, des bouteilles de bouteilles, des revêtements qui neutralisent les vibrations; Et surtout il est utilisé, avec sa version synthétique, le caoutchouc isoprène, pour la production de masse de pneus.
L'isoprène, comme le polygrene, peut être mélangé à d'autres polymères, tels que les caoutchoucs de frottement d'étirement étirement ou du butadiène, pour produire des matériaux encore plus résistants et durables. C'est-à-dire qu'il est utilisé pour la synthèse de plusieurs copolymères élastiques.
En dehors de l'industrie du caoutchouc, l'isoprène est destiné comme un matériau de départ pour la synthèse des vitamines, des arômes, des stéroïdes, des parfums et toute autre substance isopreneide qui est plus viable pour la synthétiser que de l'obtenir à partir de sources naturelles à partir de sources.
Les références
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison et Boyd. (1987). Chimie organique. (Cinquième édition). Addison-wesley iberoamericana.
- Wikipédia. (2020). Isoprène. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2020). Isoprène. PubChem Comunund Résumé pour CID 6557. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Elsevier B.V. (2020). Isoprène. ScienceDirect. Récupéré de: ScienceDirect.com
- Base de données des propriétés du polymère. (2020). Rubber isoprène: propriétés et applications. Récupéré de: polymerdatabase.com
- « Unités ioniques force, comment la calculer, exemples
- Structure de dihydroxyacétone, propriétés, obtention, utilisations »

