Diphénylamine
- 1295
- 37
- Raphaël Meyer
Quelle est la défilamine?
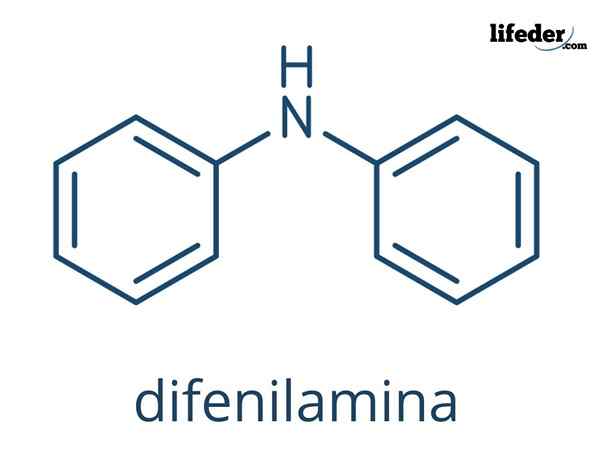
La Diphénylamine C'est un composé organique dont la formule chimique est (c6H5)2NH. Son nom indique qu'il s'agit d'une amine, ainsi que de sa formule (-nh2). D'un autre côté, le terme "diffenil" fait référence à la présence de deux anneaux aromatiques liés à l'azote. Par conséquent, la défilamine est une amine aromatique.
Dans le monde des composés organiques, le mot aromatique n'est pas nécessairement lié à l'existence de ses odeurs, mais aux caractéristiques qui définissent leurs comportements chimiques contre certaines espèces.

Dans le cas de la diphénylamine, son aromaticité et le fait que leur solide présente un arôme distinctif coïncide. Cependant, la fondation ou les mécanismes qui régissent ses réactions chimiques peuvent s'expliquer par son caractère aromatique, mais pas à cause de son arôme agréable.
Sa structure chimique, sa basicité, son aromaticité et ses interactions intermoléculaires sont les variables responsables de ses propriétés: de la couleur de ses cristaux à son applicabilité en tant qu'agent antioxydant.
Structure chimique de la défilamine

Dans les images supérieures, les structures chimiques de la diffénilamine sont représentées. Les sphères noires correspondent aux atomes de carbone, aux atomes blancs à l'hydrogène et au bleu à l'atome d'azote.
La différence entre les deux images est le modèle de la façon dont ils représentent graphiquement la molécule. Dans le plus bas, il met en évidence l'aromaticité des anneaux avec les lignes parsemées en noir et, également, la géométrie plate de ces anneaux est en évidence.
Aucune des deux images ne montre la paire d'électrons solitaire non partagée sur l'atome d'azote. Ces électrons "marchent" à travers le système π conjugué des doubles liaisons dans les anneaux. Ce système forme une sorte de nuage circulant qui permet des interactions intermoléculaires; c'est-à-dire avec d'autres anneaux d'une autre molécule.
Il peut vous servir: Thermomètre de laboratoire: caractéristiques, à quoi sert-il, utilisation, exemplesCe qui précède signifie que le couple d'azote non partagé se promène dans les deux anneaux, en distribuant dans ces derniers sa densité électronique, puis ils reviennent à l'azote, pour répéter le cycle.
Dans ce processus, la disponibilité de ces électrons diminue, entraînant une diminution de la basicité de la dipelamine (sa tendance à donner des électrons en tant que base de Lewis).
Dipénylamine utilise / applications
La diphénylamine est un agent oxydant capable de remplir une série de fonctions, et parmi lesquelles sont les suivantes:
- Pendant leur stockage, les pommes et les poires éprouvent un processus physiologique appelé brouillard, lié à la production de Trienos conjugués, ce qui entraîne des dommages cutanés des fruits. L'action de la dipénylamine permet d'augmenter la période de stockage, réduisant les dommages des fruits à 10% de ce qui est observé en leur absence.
- Lors de la lutte contre l'oxydation, la diphénylamine et ses dérivés étendent le fonctionnement des moteurs en évitant l'épaississement de l'huile utilisée.
- La diphénylamine est utilisée pour limiter l'action de l'ozone dans la fabrication du caoutchouc.
- La diphénylamine est utilisée dans la chimie analytique pour la détection des nitrates (non3-), Chlorates (CLO3-) et d'autres agents oxydants.
- C'est un indicateur utilisé dans les tests de détection d'empoisonnement au nitrate.
- Lorsque l'ARN est hydrolysé pendant une heure, il réagit avec la défilamine; Cela permet sa quantification.
- En médecine vétérinaire, le dipe -pilamine est utilisé par voie topique dans la prévention et le traitement des manifestations du ver boreride chez les animaux reproducteurs.
- Certains dérivés de la duélamine appartiennent à la catégorie des anti-inflammatoires non stéroïdiens. Ils peuvent également avoir des effets pharmacologiques et thérapeutiques tels que les antimicrobiens, les analgésiques, les anticonvulsivants et l'activité anti-cancer.
Préparation de la dipénylamine
Naturellement, la défilamine est produite dans l'oignon, dans les coriantros, dans les feuilles du thé vert et noir, et dans les coquilles des agrumes. Synthétiquement, il existe de nombreux itinéraires qui mènent à ce composé, comme:
Déamination thermique de l'aniline
Il est préparé par désamination thermique de l'aniline (c6H5NH2) En présence de catalyseurs oxydants.
Si l'aniline dans cette réaction n'incorpore pas d'atome d'oxygène à sa structure, pourquoi oxyder-tu? Parce que l'anneau aromatique est un groupe d'attracteur d'électrons, contrairement à l'atome H, qui donne sa faible densité électronique d'azote dans la molécule.
2 c6H5NH2 => (C5H5)2 NH + NH3
De plus, l'aniline peut réagir avec du sel de chlorhydrate d'aniline (C6H5NH3+CL-) sous un chauffage de 230 ºC pendant vingt heures.
C6H5NH2 + C6H5NH3+CL- => (C5H5)2 NH
Réaction de phénotiazine
La dipénylamine provient plusieurs dérivées lorsqu'elles sont combinées avec différents réactifs. L'un d'eux est la phénotiazine, qui, synthétisant avec le soufre, est un précurseur de dérivés à action pharmaceutique.
(C6H5)2Nh + 2s => s (c6H4) Nh + h2S

Propriétés de la dipénylamine
La dipénylamine est un solide cristallin blanc qui, selon ses impuretés, peut acquérir des tons bronchneaux, ambre ou jaunes. Il a un arôme de fleur agréable, il a un poids moléculaire de 169,23 g / mol et une densité de 1,2 g / ml.
Les molécules de ces solides interagissent par les forces de van der Waals, parmi lesquelles des ponts d'hydrogène formés par des atomes d'azote (NH-NH) et l'empilement des anneaux aromatiques, reposant leurs "nuages électroniques" l'un sur l'autre.
Peut vous servir: sulfure de zinc (ZNS)Comme les anneaux aromatiques occupent beaucoup. Ce qui précède fait que le solide n'a pas de point de fusion très élevé (53 ºC).
Cependant, à l'état liquide, les molécules sont plus séparées et l'efficacité des ponts d'hydrogène s'améliore. De même, la défilamine est relativement lourde, nécessitant beaucoup de chaleur pour se déplacer vers une phase gazeuse (302 ºC, son point d'ébullition). Cela est également dû en partie au poids et aux interactions des anneaux aromatiques.
Solubilité et basicité
Il est très insoluble dans l'eau (0,03 g / 100 g d'eau) en raison du caractère hydrophobe de ses anneaux aromatiques. Au lieu de cela, il est très soluble dans les solvants organiques tels que le benzène, le tétrachlorure de carbone (CCL4), l'acétone, l'éthanol, la pyridine, l'acide acétique, etc.
Sa constante d'acidité (PKA) est de 0,79, ce qui fait référence à l'acidité de son acide conjugué (C6H5NH3+). Le proton ajouté à l'azote a tendance à se séparer, car la paire d'électrons avec laquelle il est lié peut traverser les anneaux aromatiques. Ainsi, une instabilité élevée C6H5NH3+ Il reflète la faible basité de la diffénilamine.
Les références
- La Lubrizol Corporation. (2018). Antioxydants diphénylamine. Récupéré de lubrizol.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Applications pharmacologiques de la diphénylamine et de son dérivé comme composé bioactif puissant: une revue. Composés bioactifs actuels, volume 13.
- Préparer. (2015-2016). Préparation de la diphénylamine. Récupéré de prepchem.com
- Se publier. (2018). Diphénylamine. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Wikipédia. (2018). Diphénylamine. Récupéré de.Wikipédia.org

