Chlorure de strontium (SRCL2)
- 3237
- 713
- Paul Dumas
Qu'est-ce que le chlorure de strontium?
Il Chlorure de strontium Il s'agit d'un composé inorganique formé par le strontium, le métal alcalinoterreo (SR. Becamgbara) et halogène du chlore. Parce que les deux éléments ont des électronégativités très différentes, le composé est un solide ionique dont la formule chimique est SRCL2.
Comme c'est un solide ionique, il est composé d'ions. Dans le cas de SRCL2, Ils sont un cation SR2+ Pour tous les deux anions CL-. Ses propriétés et ses applications sont similaires au chlorure de calcium et de baryum.
Comme le chlorure de calcium (CACL2), est hygroscopique et ses cristaux absorbent l'eau pour former du sel hexahydrate, dans lequel six molécules d'eau sont présentes dans le réseau cristallin (SRCL2· 6h2SOIT). En fait, la disponibilité de l'hydrate est supérieure au SRCL2 anhydre (sans eau).
L'une de ses principales applications est un précurseur des autres composés du strontium; c'est-à-dire qu'il constitue la source de strontium dans certaines synthèses chimiques.
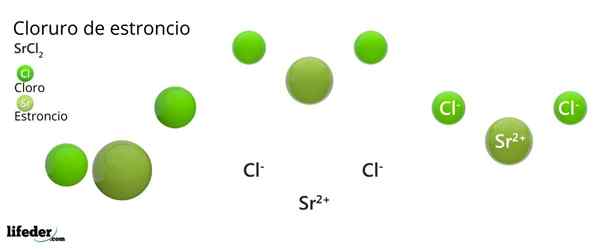
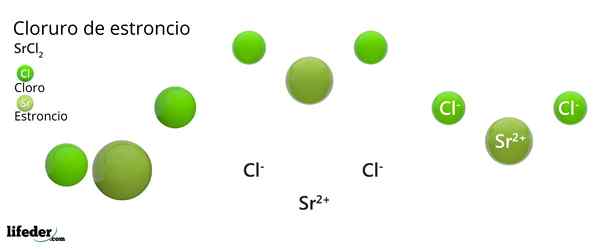
Structure chimique du chlorure de strontium
 Structure cristalline du chlorure de strontium
Structure cristalline du chlorure de strontium L'image supérieure représente le type de structure cristalline déformé du SRCL2 anhydre. En cela, les petites sphères vertes correspondent aux ions Sr2+, Tandis que les sphères vertes volumineuses représentent les ions CL-.
Dans cette structure, chaque sr ion2+ Il est "emprisonné" par huit cltins-, Par conséquent avoir un nombre de coordination égal à 8 et, peut-être, une géométrie cubique autour de lui. C'est-à-dire que quatre sphères vertes font le toit du cube, tandis que les quatre autres le sol, ont localisé le SR2+ Au centre.
Quelle serait la structure de la phase de soda? La structure de Lewis pour ce sel est CL-SR-CL, apparemment linéaire et en supposant cent pour cent de ses liens. Cependant, dans une phase gazeuse -SRCL2(g) - Cette "ligne" montre un angle d'environ 130 °, étant en fait une sorte de V.
Peut vous servir: État gazeux: caractéristiques, loi générale, exemplesCette anomalie n'a pas pu être expliquée avec succès, compte tenu du fait que Strontium n'a pas partagé d'électrons qui occupent le volume électronique. Peut-être peut-être causé par la participation d'une orbite D dans les liens, ou à une perturbation du noyau-électron.
Utilisations / applications du chlorure de strontium
Le SRCL2· 6h2Ou il a été utilisé comme additif dans les polymères organiques; Par exemple, dans l'alcool polyvinylique, afin de modifier ses propriétés mécaniques et électriques.
Il est utilisé comme ferrite de strontium dans la fabrication d'aimants en céramique et en verre destinés à fabriquer le cristal avant télévisé.
Réagit avec le chromate de sodium (Na2CRO4) pour produire du chromate de strontium (SRCRO4), qui est utilisé comme peinture résistante à la corrosion pour l'aluminium.
Quand ils sont chauffés avec du feu, les composés du strontium brillent avec une flamme rougeâtre, c'est pourquoi ils sont destinés à l'élaboration des fusées et des feux d'artifice.
Applications médicinales
Le radio-isotope du chlorure de strontium 89 (l'isotope le plus abondant est le 85M.
L'utilisation de solutions diluées (3-5%) pendant plus de deux semaines dans le traitement de la rhinite allergique (inflammation chronique de la muqueuse nasale) montre des améliorations dans la diminution des éternuements et des frottements nasaux.
Une fois qu'il a été utilisé dans les formulations de la pâte dentifric pour réduire la sensibilité dentaire, formant une barrière sur les microtubules dentins.
Les études de ce composé démontrent une efficacité thérapeutique par rapport à la prednisolone (métabolite du médicament à la prednisone) dans le traitement de la colite ulcéreuse.
Il peut vous servir: fraction molaire: comment il est calculé, exemples, exercicesSes résultats sont basés sur le modèle des rats; Malgré cela, cela représente l'espoir pour les patients qui souffrent également d'ostéoporose, car ils peuvent aller au même médicament pour lutter contre les deux maladies.
Il est utilisé pour synthétiser le sulfate de strontium (SRSO4), encore plus dense que le SRCL2. Cependant, sa solubilité en eau minimale ne le rend pas suffisamment léger pour être appliqué en radiologie, contrairement au sulfate de baryum (BASO4).
Préparation du chlorure de strontium
Le chlorure de strontium peut être préparé par action directe de l'acide chlorhydrique (HCl) sur du métal pur, survenant ainsi une réaction de type redox:
Mr (S) + HCL (AC) => SRCL2(AC) + H2(g)
Ici, le métal strontium est oxydé en donnant deux électrons pour permettre la formation d'hydrogène gazeux.
Aussi, le carbonate d'hydroxyde et de strontium (SR (OH)2 et SRCO3) réagir avec cet acide en le synthétisant:
SR (OH)2(s) + 2hcl (ac) => srcl2(AC) + 2H2Ou (l)
SRCO3(s) + 2hcl (ac) => srcl2(AC) + CO2(g) + h2Ou (l)
En appliquant des techniques de cristallisation, SRCL est obtenu2· 6h2SOIT. Après déshydraté par action thermique jusqu'à ce que le SRCL produise enfin2 anhydre.
Propriétés du chlorure de strontium
Les propriétés physiques et chimiques de ce composé dépendent de la question de sa forme hydratée ou anhydre. En effet2.
Anhydre
Le chlorure de strontium est un solide cristallin blanc, avec un poids moléculaire de 158,53 g / mol, et une densité de 3,05 g / ml.
Ses points de fusion (874 ºC) et l'ébullition (1250 ºC) sont élevés, indiquant les fortes interactions électrostatiques entre les ions Sr2+ et cl-. Il reflète également la grande énergie réticulaire cristalline que sa structure anhydre a.
Peut vous servir: acétate de celluloseEnthalpie de la formation SRCL2 solide est de 828,85 kJ / mol. Il s'agit de l'énergie thermique libérée par chaque taupe formée de ses composants dans ses états standard: chlore et gaz solide pour le strontium.
Hexahydrate
Sous forme d'hexahydrate, il a un poids moléculaire plus élevé que sa forme anhydre (267 g / mol), et une densité plus faible (1,96 g / ml). Cette diminution de sa densité est due au fait que les molécules d'eau "dilatent" les cristaux, augmentant le volume; Par conséquent, la densité de la structure diminue.
Il est presque deux fois dense que l'eau à température ambiante. Sa solubilité dans l'eau est très élevée, mais en éthanol, elle est légèrement soluble. Cela est dû à son caractère organique malgré sa polarité. C'est-à-dire que l'hexahydrate est un composé polaire inorganique. Enfin, à 150 ºC, il devient déshydraté pour produire du sel anhydre:
SRCL2· 6h2Ou (s) => srcl2(s) + 6H2O (g)
Les références
- Wikipédia. (2018). Chlorure de strontium. Récupéré de.Wikipédia.org
- Banc de drogue. (2018). Chlorure de strontium SR-89. Drugbank a récupéré.CA
- Se publier. (2018). Chlorure de strontium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement
- Taureau. Mater. (2010). Influence du chlorure de stontium granulaire comme additifs sur les propriétés électriques et mécaniques sous. SCI., Vol. 33, non. 2, pp. 149-155. Académie indienne des sciences.
- Ccoil. (4 septembre 2009). Stontium-chlorure -Xtal-3d-sf. [Chiffre]. Récupéré le 13 avril 2018 de: Commons.Wikimedia.org
- Toutes les réactions. Srcl2 - chlorure de stontium. Récupéré de toutes les réactions.com