Structure du dichlorométhane, propriétés, utilisations, toxicité

- 4582
- 907
- Noa Da silva
Il dichlorométhane, Également connu sous le nom de chlorure de méthylène, c'est un composé organique dont la formule chimique est CH2CL2. Plus précisément, il s'agit d'un halogogénide d'alkyle dérivé du gaz de méthane. Contrairement au méthane, ce composé est un liquide incolore et polaire.
Il a été initialement synthétisé en 1839 par le chimiste et physicien français Henri Victor Regnault (1810-1878), qui a réussi à l'isoler à partir d'un mélange de chlore et de chlorométhane exposé à la lumière du soleil.
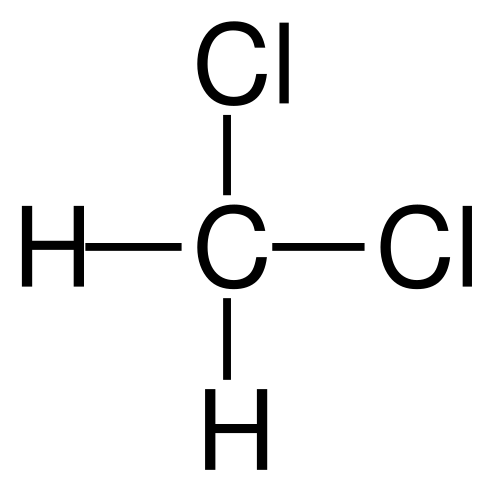 Formule structurelle du dichlorométhane. Source: Jü [domaine public]
Formule structurelle du dichlorométhane. Source: Jü [domaine public] Le dichlorométhane se produit industriellement par le traitement du méthane ou du chlorométhane avec du chlore gazeux à haute température (400-500 ºC). Avec le dichlorométhane, ils se produisent dans le processus de chloroforme et de tétrachlorure de carbone, qui sont séparés par distillation.
Le dichlorométhane est utilisé comme solvant qui permet le soudage des matériaux plastiques et de dégraisser les métaux. Il est également utilisé dans le café et la décafeine de thé.
Le dichlorométhane est un composé toxique qui peut produire par irritation par inhalation des narines et de la gorge. Des dommages hépatiques ont été signalés chez les travailleurs exposés à des concentrations élevées du dichlorométhane. De plus, il est un agent mutagène, soupçonné d'être cancérigène.
[TOC]
Structure
 Structure moléculaire du dichlorométhane. Source: Gabriel Bolívar via Molview.
Structure moléculaire du dichlorométhane. Source: Gabriel Bolívar via Molview. Dans la première image, la formule structurelle du CH a été montrée2CL2, dans lequel leurs liaisons covalentes C-H et C-CL se distinguent. Et sa structure représentée par un modèle de sphères et de barres. Notez à première vue que les liaisons C-H (sphères blanches) sont courtes, tandis que les liaisons C-Cl (sphères vertes) sont longues.
Géométrie Cho2CL2 C'est tétraédrique; mais déformé à cause des atomes de chlore les plus volumineux. Une extrémité du tétraèdre est définie par les deux atomes de chlore, plus électronégatifs que l'hydrogène et le carbone. Par conséquent, dans la molécule de ch2CL2 Un moment dipolaire permanent est établi (1.6d).
Peut vous servir: réaction de neutralisationCela permet aux molécules de dichlorométhane d'interagir entre elles par les forces dipol-dipolo. De même, ces interactions intermoléculaires sont responsables de ce que ce composé existe en tant que liquide malgré sa faible masse moléculaire; Un liquide qui, cependant, est assez volatile.
Propriétés
Apparence
Liquide incolore.
Masse molaire
84,93 g / mol.
Odeur
Doux, similaire au chloroforme.
Seuil d'odeur
205 - 307 ppm.
Densité
1 3266 g / cm3 (20 ºC).
Point de fusion
- 97,6 ºC.
Point d'ébullition
39,6 ºC.
Solubilité dans l'eau
25,6 g / L à 15 ºC et 5,2 g / L à 60 ºC.
Le dichlorométhane est à peine soluble dans l'eau. Tandis que les deux molécules, Cho2CL2 et h2Ou, ils sont polaires, leurs interactions sont peut-être inefficaces en raison de la répulsion entre le chlore et les atomes d'oxygène.
Solubilité dans d'autres solvants
Miscible avec de l'acétate d'éthyle, de l'alcool, de l'hexane, du benzène, du tétrachlorure de carbone, de l'éther dietyl, du chloroforme et du diméthylformamide.
Coefficient de partition octanol / eau
Journal P = 1,19.
La pression de vapeur
57,3 kPa (25 ºC). Cette pression correspond à environ 5,66 atm, reflétant une pression à grande vapeur.
Densité de vapeur
2,93 dans la relation aérienne prise comme 1.
Index de réfraction (πd)
1 4244 (20 ºC).
Gelée
0,413 CP (25 ºC).
point d'allumage
Le dichlorométhane n'est pas inflammable, mais lorsqu'il est mélangé avec l'air, il forme des vapeurs inflammables au-dessus de 100 ºC.
Température d'auto-direction
556 ºC.
La stabilité
Il est stable à température ambiante en l'absence d'humidité, ayant une stabilité relative par rapport à ses congénères: chloroforme de tétrachlorure de carbone et tétrachlorure.
Il a tendance à carboniser à des températures élevées (300-450 ºC), lorsque leurs vapeurs entrent en contact avec des chlorures en acier et en métal.
Décomposition
Il peut être décomposé en contact avec des surfaces chaudes ou une flamme, émettant des vapeurs toxiques et irritantes de phosgen et de chlorure d'hydrogène.
Peut vous servir: électron différentielCorrosion
Le dichlorométhane attaque certaines formes de plastiques, de caoutchoucs et de revêtements.
Chaleur de vaporisation
28,82 kJ / mol a 25 ºC.
Tension superficielle
28.20 dynas / cm à 25 ºC.
Réactivité
Le dichlorométhane réagit fortement avec les métaux actifs, comme le potassium, le sodium et le lithium. Réagit avec des bases fortes, par exemple, le potassium bouthexide. Il est incompatible avec les substances caustiques, les oxydants et les métaux chimiquement actifs.
De plus, il réagit avec l'oxygène liquide dans les alliages de sodium et de potassium et le tétroxyde d'azote. En contact avec l'eau, vous pouvez faire fonctionner des aciers inoxydables, du nickel, du cuivre, ainsi que du fer.
Applications
La plupart des utilisations et applications du dichlorométhane sont basées sur ses propriétés en tant que solvant. En raison de cette caractéristique, le dichlorométhane est utilisé dans les industries de la production alimentaire, des transports, des médicaments, etc.
Préparation des aliments
Le dichlorométhane est utilisé dans les grains de café décaféinés et les feuilles de thé. Il est également utilisé pour l'extraction du houblon pour la bière, les boissons et autres drapeaux alimentaires, ainsi que pour la transformation des épices.
Industrie pharmaceutique
Le dichlorométhane est utilisé pour la préparation de la céphalosporine et de l'ampicilline, en plus de la fabrication d'antibiotiques, de stéroïdes et de vitamines.
La photographie
Il est également utilisé comme solvant dans la production de triacétate de cellulose (CTA), utilisé dans la création de films de sécurité.
Industrie électronique
Il s'agit d'un composé idéal pour la production de plaques de circuit imprimées, en utilisant la surface d'aluminium avant d'ajouter la plaque Photoret.
Des peintures
Le dichlorométhane est un solvant trouvé dans les vernis et dans les séparateurs de peinture, utilisés pour éliminer les vernis ou le revêtement de peintures de différents types de surfaces.
Transport
Il sert à dégraisser les pièces et les surfaces métalliques présentes dans l'équipement ferroviaire, ainsi que dans les composants des avions.
Peut vous servir: eau distilléeAutres utilisations
Il est utilisé comme propulseur par pulvérisation (aérosols) et comme agent d'extension pour la mousse de polyuréthane. Il est également utilisé comme liquide dans certains types de lumières de Noël.
Toxicité
Effets aigus
L'inhalation du dichlorométhane peut provoquer l'irritation des voies respiratoires supérieures, la toux, la respiration sifflante ou le manque d'air.
Il peut produire des rougeurs cutanées, et si le composé reste longtemps dessus, provoquer des brûlures chimiques. En contact avec les yeux, le dichlorométhane produit une grave irritation qui peut s'étendre à une brûlure.
De plus, il agit comme une neurotoxine générant des altérations visuelles, auditives et psychomotrices; Mais ces effets sont réversibles pour cesser l'inhalation du dichlorométhane.
Effets chroniques
Le dichlorométhane peut affecter le système nerveux central et générer des maux de tête, une confusion mentale, des nausées, des vomissements et une perte de mémoire.
Chez les animaux, il produit des effets nocifs sur le foie, les reins, le système nerveux central et le système cardiovasculaire.
Dès que la cancérogenèse n'a pas signalé une augmentation significative des décès par cancer chez les travailleurs exposés au dichlorométhane. Cependant, les études animales ont montré une augmentation attribuable au dichlorométhane dans l'incidence du cancer du foie et des poumons, ainsi que des tumeurs bénignes des glandes mammaires.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5faire Édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (dixe Édition.). Wiley Plus.
- Centre national d'information sur la biotechnologie. (2020). Dichlorométhane. Base de données PubChem., CID = 6344. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2020). Dichlorométhane. Récupéré de: dans.Wikipédia.org
- Brumer. (14 juillet 2018). Dichlorométhane. Récupéré de: Brumer.com
- MSD en ligne. (2019). Dangers de dichlorométhane (chlorure de méthylène). Récupéré de: msdsonline.com
- EPA. (2000). Chlorure de méthylène (dichlorométhane). [PDF]. Récupéré de: EPA.Gouvernement
- « Détermination des méthodes et exemples de cendres
- Traditions culturelles de la Corée du Sud, coutumes, gastronomie, religion »

