Courbe de chauffage qu'est-ce que, comment c'est faire, des exemples

- 2503
- 559
- Raphaël Meyer
Ongle Courbe de chauffage C'est la représentation graphique de la façon dont la température d'un échantillon varie en fonction du temps, en maintenant la pression constante et en ajoutant de la chaleur uniformément, c'est-à-dire à un rythme constant.
Pour construire un tel graphique, des paires de températures et des valeurs de temps sont prises, qui représentent par la suite la température sur l'axe vertical (ordonné) et le temps sur l'axe horizontal (Abscissa).
 Figure 1. La courbe de chauffage d'une substance est obtenue en ajoutant de la chaleur et en mesurant la température à chaque intervalle de temps. Source: Pixabay.
Figure 1. La courbe de chauffage d'une substance est obtenue en ajoutant de la chaleur et en mesurant la température à chaque intervalle de temps. Source: Pixabay. Ensuite, la courbe la plus appropriée à ces points expérimentaux est ajustée et enfin un graphique de la température T est obtenu en fonction du temps t: t (t).
[TOC]
Quelle est la courbe de chauffage?
Alors qu'il se réchauffe, une substance traverse des états successivement divers: être solide peut cuire à la vapeur, passant presque toujours par l'état liquide. Ces processus sont appelés changements d'état, dans lesquels l'échantillon augmente son énergie interne tout en ajoutant de la chaleur, comme l'indique la théorie cinétique moléculaire.
En ajoutant de la chaleur à un échantillon, il y a deux possibilités:
- La substance augmente sa température, compte tenu du fait que ses particules sont agitées avec une plus grande intensité.
- Le matériau passe par un changement de phase, dans lequel la température reste constante. Ajouter la chaleur a pour effet d'affaiblir dans une certaine mesure les forces qui gardent les particules cohésives, il est donc facile de passer de la glace à l'eau liquide, par exemple.
La figure 2 montre les quatre états de la matière: solide, liquide, gaz et plasma, et les noms des processus qui permettent la transition les uns des autres. Les flèches indiquent le sens du processus.
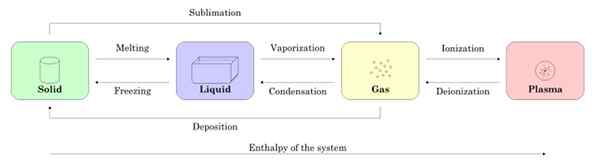 Figure 2. Les états du sujet et les processus nécessaires pour passer entre l'un et l'autre. Source: Wikimedia Commons.
Figure 2. Les états du sujet et les processus nécessaires pour passer entre l'un et l'autre. Source: Wikimedia Commons. -Les changements d'état dans une substance
En commençant par un échantillon à l'état solide, lorsque la fusion passe à l'état liquide, comme il est vaporisé, il devient du gaz et par l'ionisation, il devient plasma.
Il peut vous servir: propriétés magnétiques des matériauxLe solide peut devenir directement du gaz par le processus appelé sublimation. Il y a des substances qui subissent facilement à la température ambiante. Le plus connu est CO2 ou glace sèche, ainsi que le naphtalène et l'iode.
Alors que l'échantillon traverse un changement d'état, la température reste constante jusqu'à ce qu'elle atteigne le nouvel état. Cela signifie que si par exemple il y a une partie de l'eau liquide qui a atteint son point d'ébullition, sa température reste constante jusqu'à ce que toute l'eau soit devenue de la vapeur.
Pour cette raison, la courbe de chauffage devrait être composée d'une combinaison de sections de croissance et de sections horizontales, où ces derniers correspondent aux changements de phase. La figure 3 montre l'une de ces courbes pour une substance donnée.
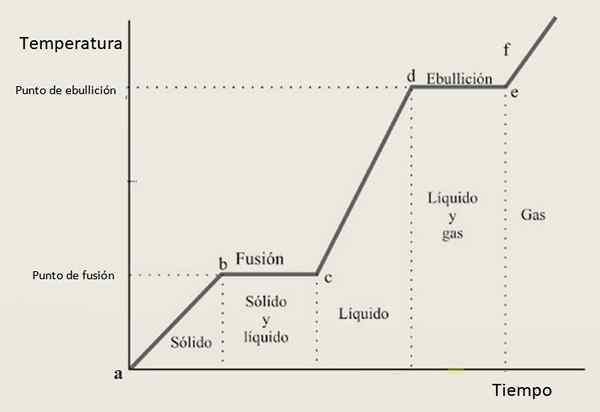 figure 3. Une courbe de chauffage d'une substance donnée, avec la configuration typique basée sur les étapes et les pentes.
figure 3. Une courbe de chauffage d'une substance donnée, avec la configuration typique basée sur les étapes et les pentes. Interprétation de la courbe de chauffage
Dans les intervalles de croissance UN B, CD et Ef La substance se trouve respectivement comme solide, liquide et gaz. Dans ces régions, l'énergie cinétique augmente et avec elle la température.
Alors que en avant JC Son état du solide au liquide change, donc les deux phases coexistent. C'est le cas dans la section de, dans lequel l'échantillon passe du liquide gazier. Voici la modification de l'énergie potentielle, et la température reste constante.
La procédure inverse est également possible, c'est-à-dire que l'échantillon peut être refroidi afin qu'il adopte successivement d'autres états. Dans ce cas, on parle de courbe de refroidissement.
Les courbes de chauffage ont le même aspect général pour toutes les substances, bien que bien sûr pas les mêmes valeurs numériques. Certaines substances nécessitent plus de temps que d'autres pour changer l'état et fondre et vaporiser à différentes températures.
Ces points sont connus respectivement comme un point de fusion et un point d'ébullition, et sont des caractéristiques de chaque substance.
Peut vous servir: Miroirs plats: équation, comportement, graphiquesC'est pourquoi les courbes de chauffage sont très utiles, car elles indiquent la valeur numérique de ces températures pour des millions de substances qui existent sous forme de solides et de liquides dans la gamme de températures considérées comme normales et à la pression atmosphérique.
Comment une courbe de chauffage est-elle fabriquée?
En principe, il est très simple: il suffit de placer un échantillon de substance dans un récipient fourni avec un agitateur, d'introduire un thermomètre et de chaleur uniformément.
Simultanément, au début de la procédure, un chronomètre est activé et les couples de température correspondants sont notés.
La source de chaleur peut être un briquet à gaz, avec une bonne vitesse de chauffage ou une résistance électrique qui, lorsque la chaleur émet de la chaleur, qui peut se connecter à une source variable pour obtenir différentes pouvoirs.
Pour plus de précision, il existe deux techniques largement utilisées dans le laboratoire de chimie:
- Analyse thermique différentielle.
- Calorimétrie de balayage différentiel.
Ils comparent la différence de température entre l'échantillon à l'étude et un autre échantillon de référence avec une température de fusion élevée, presque toujours un oxyde d'aluminium. Ces méthodes cherchent à trouver facilement des points de fusion et d'ébullition.
Exemples (eau, fer ...)
Considérez les courbes de chauffage pour l'eau et le fer montré sur la figure. L'échelle de temps n'est pas montrée, mais elle est immédiate.
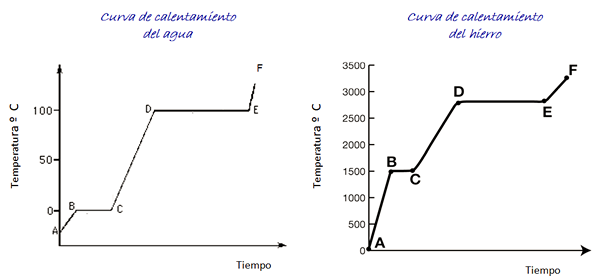 Figure 4. Courbes de chauffage de l'eau et du fer.
Figure 4. Courbes de chauffage de l'eau et du fer. L'eau est une substance universelle et la plage de température nécessaire pour voir ses changements d'État est facile à réaliser en laboratoire. Pour le fer, des températures beaucoup plus élevées sont nécessaires, mais comme indiqué ci-dessus, la forme du graphique ne change pas considérablement.
Peut vous servir: Théorème de Steiner: explication, applications, exercicesLa glace fondante
Lors du chauffage de l'échantillon de glace, selon le graphique, nous sommes au point A, à une température inférieure à 0 ° C. Il est observé que la température augmente à un rythme constant jusqu'à ce qu'elle atteigne 0º C.
Les molécules d'eau à l'intérieur de la glace vibrent plus. Une fois la température de fusion (point B) atteint, les molécules peuvent déjà se déplacer devant un autre.
L'énergie qui arrive est investie dans la réduction de la force d'attraction entre les molécules, de sorte que la température entre B et C reste constante pour toute glace a fondu.
Transformer l'eau en vapeur
Une fois que l'eau est totalement à l'état liquide, la vibration des molécules augmente à nouveau et la température augmente rapidement entre C et D au point d'ébullition de 100 ° C. Entre D et E, la température reste dans cette valeur tandis que l'énergie qui arrive est responsable de toute l'eau du conteneur pour s'évaporer.
Si toute la vapeur d'eau est contenue dans un conteneur, il peut être poursuivi du point E au point F, dont la limite n'est pas indiquée dans les graphiques.
Un échantillon de fer peut traverser ces mêmes changements. Cependant, étant donné la nature du matériau, les gammes de température sont très différentes.
Les références
- Atkins, P. Principes de chimie: les chemins de découverte. Pan -American Medical Editorial. 219-221.
- Chung, P. Courbes de chauffage. Récupéré de: Chem.Bibliothèque.org.
- Courbes de chauffage. Chaleur de fusion et vaporisation. Récupéré de: wikipremed.com.
- Hewitt, Paul. 2012. Sciences physiques conceptuelles. 5e. Élégant. Pearson. 174-180.
- Université de Valladolid. Diplôme en chimie, récupéré de: l'hébergement.raisin.est.
- « Étapes de cycle de carnot, applications, exemples, exercices
- Caractéristiques vertes de Bromocresol, préparation, utilisations »

