Mécanismes de corrosion galvanique, exemples, protection

- 3430
- 1077
- Prof Noah Collet
La Corrosion galvanique ou électrochimique C'est un processus par lequel un métal ou un alliage est dégradé de manière plus vertigineuse par rapport à son oxydation conventionnelle. On peut dire qu'il s'agit d'une oxydation accélérée et même dirigée intentionnellement; Comme dans les batteries ou les batteries.
Cela se passe dans une série de conditions. Tout d'abord, il doit y avoir un métal actif, appelé anode. Aussi, et deuxièmement, il doit y avoir un peu de métal noble réactif appelé cathode. Les troisième et quatrième conditions sont la présence d'un milieu où les électrons sont propagés, comme l'eau et les espèces ioniques ou électrolytiques.
 Couronne de fer oxydée. Source: pixnio.
Couronne de fer oxydée. Source: pixnio. La corrosion galvanique est observable en particulier dans les environnements marins ou sur les rives des plages. Les courants d'air soulèvent des masses de vapeur d'eau, qui à leur tour, traînent certains ions; Ce dernier finit par adhérer à une fine couche d'eau ou des gouttes qui reposent sur la surface métallique.
Ces conditions d'humidité et de salinité favorisent la corrosion des métaux. C'est-à-dire qu'une couronne de fer comme celle de l'image supérieure s'oxydera plus rapidement si elle est exposée à la mer de la mer.
La facilité qu'un métal devra s'oxyder par rapport à une autre peut être mesurée quantitativement grâce à ses potentiels de réduction; Dans les livres de chimie, il y a des tables avec ces potentiels et. Plus vous êtes négatif, plus votre tendance à oxyder.
De plus, si ce métal est en présence d'un autre avec un potentiel de réduction très positif, ayant donc un grand ΔE, l'oxydation du métal réactif sera plus agressive. D'autres facteurs, tels que le pH, la force ionique, l'humidité, la présence d'oxygène et la relation entre les zones du métal oxydé et celle réduite, sont également importantes.
[TOC]
Mécanismes
Concepts et réactions
Avant de traiter les mécanismes derrière la corrosion galvanique, certains concepts doivent être clarifiés.
Dans une réaction rédox, une espèce perd des électrons (oxydé) tandis qu'un autre les gagne (il est réduit). L'électrode sur laquelle l'oxydation se produit est appelée anode; Et sur lequel la réduction se produit, la cathode (en anglais la règle némonique est généralement utilisée Chat rouge se souvenir).
Ainsi, pour une électrode (une pièce, vis, etc.) d'un métal m, si cela est oxydé, il est dit que c'est l'anode:
M => mn+ + ne-
Le nombre d'électrons libérés sera égal à l'ampleur de la charge positive de cation mn+ résultant.
Ensuite, une autre électrode ou métal (les deux métaux doivent être en contact d'une manière ou d'une autre), reçoit les électrons libérés; Mais cela ne subit pas de réaction chimique s'ils gagnent des électrons, car cela ne serait que les effectuer (courant électrique).
Par conséquent, il doit y avoir une autre espèce en solution que ces électrons peuvent officiellement accepter; Aussi facile à réduire les ions métalliques, par exemple:
Peut vous servir: système inhomogèneRn+ + ne- => R
C'est-à-dire qu'une couche de métal r se formerait et l'électrode deviendrait plus lourde; tandis que le métal M perdrait la masse parce que leurs atomes se dissolvent.
Dépolariseurs
Et s'il n'y avait pas de cations métalliques qui pourraient être suffisamment réduites? Dans ce cas, d'autres espèces présentes au milieu prendront des électrons: les dépolarizadores. Ceux-ci sont intimement liés au pH: o2, H+, Oh- et h2SOIT.
Les électrons d'oxygène et d'eau dans une réaction exprimée par l'équation chimique suivante:
SOIT2 + 2h2O + 4E- => 4OH-
Tandis que iones h+ Ils se transforment en h2:
2h+ + 2E- => H2
C'est-à-dire des espèces oh- et h2 Ce sont des produits communs de corrosions galvaniques ou électrochimiques.
Même si le métal R ne participe à aucune réaction, le fait d'être plus noble qui favorise son oxydation; Et par conséquent, il y aura une plus grande production d'ions OH- o Hydrogène gazeux. Parce que, après tout, c'est la différence entre les potentiels de réduction, ΔE, l'un des principaux moteurs de ces processus.
Corrosion de fer
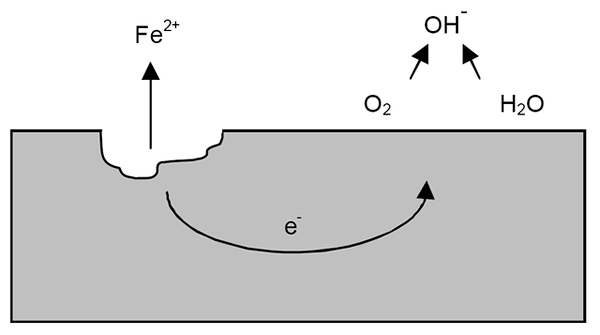 Mécanisme de corrosion pour le fer. Source: Wikipedia.
Mécanisme de corrosion pour le fer. Source: Wikipedia. Après les clarifications précédentes, l'exemple de corrosion en fer (image supérieure) peut être abordé. Supposons qu'il y ait une fine couche d'eau dans laquelle l'oxygène se dissout. Sans la présence d'autres métaux, ce seront les dépolarizadores qui marqueront les directives de réaction.
Ainsi, le fer perdra certains atomes à sa surface pour se dissoudre dans l'eau comme des cations de foi2+:
Fe => foi2+ + 2E-
Les deux électrons parcouriront la pièce en fer pour être un bon conducteur d'électricité. De sorte qu'il est connu où l'oxydation ou le site anodique a commencé; Mais pas là où la réduction ou l'emplacement du site cathodique continuera. Le site cathodique peut être n'importe où; Et plus sa zone possible est élevée, pire sera la corrosion du métal.
Supposons que les électrons atteignent un point comme indiqué dans l'image supérieure. Là, l'oxygène et l'eau souffrent de la réaction déjà décrite, par laquelle OH est libéré-. Ces anions oh- Ils peuvent réagir avec la foi2+ Former la foi (oh)2, qui précipite et souffre d'oxydations ultérieures qui la transforment finalement en rouille.
Pendant ce temps, le site anodique craque de plus en plus.
Exemples
Dans la vie quotidienne, les exemples de corrosions galvaniques sont nombreuses. Nous n'avons pas à nous référer à la couronne de fer: tout artefact en métaux peut subir le même processus en présence d'environnements humides et salins.
Peut vous servir: groupe de phosphateEn plus de la plage, l'hiver peut également contribuer les conditions idéales pour la corrosion; Par exemple, lorsque vous jetez des sels sur la neige de la route pour empêcher les voitures de patiner.
Du point de vue physique, dans les syndicats soudés de deux métaux, il peut conserver l'humidité, en tant que sites de corrosion actifs. C'est parce que les deux métaux se comportent comme deux électrodes, et le plus réactif perdra leurs électrons.
Si la production oh ion- C'est considérable, vous pouvez même exécuter la peinture de la voiture ou l'artefact en question.
Indices anodiques
On peut construire ses propres exemples de corrosions galvaniques en utilisant les tables de potentiel de réduction. Cependant, le tableau d'index anodique (simplifié par lui-même) sera choisi pour illustrer ce point.
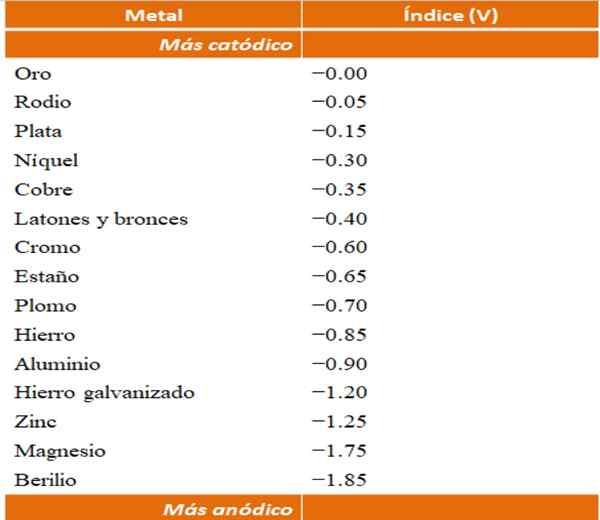 Indices anodiques pour différents métaux ou alliages. Source: Wikipedia.
Indices anodiques pour différents métaux ou alliages. Source: Wikipedia. Supposons par exemple que nous aimerions construire une cellule électrochimique. Les métaux qui sont la partie supérieure de la table des indices anodiques sont plus cathodiques; c'est-à-dire qu'ils sont facilement réduits et il sera donc difficile de les avoir en solution. Tandis que les métaux en bas sont plus anodiques ou réactifs, et fonctionne facilement.
Si nous choisissons l'or et le béryllium, les deux métaux ne pourraient pas être ensemble pendant longtemps, car le béryllium s'oxyderait avec un rapide rapide.
Et si au contraire, nous avons une solution agrandie+ Et nous y immergeons une barre d'aluminium, elle se dissoudra en même temps qui précipite les particules en argent métallique. Si cette barre se connecte à une électrode en graphite, les électrons y voyageaient pour déposer électrochimiquement de l'argent comme un film d'argent.
Et si au lieu de la barre d'aluminium est hors du cuivre, la solution deviendrait bleuâtre par la présence des ions Cu2+ dans l'eau.
Protection contre la corrosion électrochimique
Revêtements sacrifices
Supposons qu'il vise à protéger une lame de corrosion en présence d'autres métaux. L'option la plus simple serait d'ajouter du magnésium, qui couvrirait le zinc afin qu'une fois oxydé, les électrons libérés du magnésium réduisent les cations Zn2+ de retour.
Cependant, le film de MGO sur le zinc le plus tôt possible finirait par craquer, offrant un site actuel à haute densité; c'est-à-dire que la corrosion en zinc s'accélérerait fortement à ces points.
Cette technique de protection contre la corrosion électrochimique est connue comme l'utilisation du revêtement de sacrifice. Le plus connu est le zinc, utilisé dans la célèbre technique appelée galvanisation. En eux, le métal m est couvert, en particulier le fer, le zinc (foi / zn).
Peut vous servir: Phénolphthalein (C20H14O4)Encore une fois, le zinc oxyde et son oxyde sert à couvrir le fer et transmettre des électrons qui réduisent la foi2+ qui peut être formé.
Nobles revêtements
Supposons à nouveau que vous voulez protéger la même feuille de zinc, mais maintenant le chrome sera utilisé à la place du magnésium. Le chrome est plus noble (plus cathodique, voir le tableau des indices anodiques) que le zinc, et c'est pourquoi il fonctionne comme un revêtement noble.
Le problème de ce type de revêtement est qu'une fois qu'il se fissure, il favorisera et accélérera encore l'oxydation du métal ci-dessous; Dans ce cas, le zinc est encore plus corrodé que d'être couvert de magnésium.
Et enfin, il y a d'autres revêtements qui se composent de peintures, de plastiques, d'antioxydants, de graisses, de résines, etc.
Expérience pour enfants
Plaque de fer dans les sels de cuivre
Une expérience simple peut être conçue à partir du même tableau des indices anodiques. Dissoudre une quantité raisonnable (moins de 10 grammes) de CUSO4· 5h2Ou dans l'eau, un enfant est invité à s'immerger sur une plaque de fer poli. Une photo est prise et le processus est autorisé à se développer pendant quelques semaines.
La dissolution est initialement bleuâtre, mais elle commencera à perdre la coloration tandis que la plaque de fer acquiert une couleur cuivrée. C'est parce que le cuivre est noble que le fer, et donc ses cations2+ Ils seront réduits en cuivre métallique des ions attribués par l'oxydation du fer:
Fe => foi2+ + 2E-
Cu2+ + 2E- => Cu
Nettoyage d'oxyde d'argent
Les objets en argent se noircissent avec le temps, surtout s'ils sont en contact avec une source de composés de soufre. Son oxyde peut être éliminé si l'objet est immergé dans une baignoire avec du bicarbonate de sodium et du papier d'aluminium. Le bicarbonate fournit des électrolytes qui faciliteront le transport des électrons entre l'objet et l'aluminium.
En conséquence, l'enfant peut apprécier que l'objet perd ses taches noires et brillera avec sa couleur d'argent caractéristique; Tandis que le papier d'aluminium fonctionnera jusqu'à disparaître.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2019). Corrosion galvanique. Récupéré de: dans.Wikipédia.org
- Stephen Lower. (16 juin 2019). Corrosion électrochimique. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- L'université ouverte. (2018). 2.4 Processus de corrosion: corrosion galvanique. Récupéré de: ouvrir.Édu
- Brosse du service technique client Wellman Inc. (s.F.). Un guide de la corrosion galvanique. Brosser les matériaux d'ingénierie Wellman.
- Giorgio Carboni. (1998). Expériences en électrochimie. Récupéré de: Fensci.com
- « Origine du relativisme sophiste, caractéristiques, exemples
- Structure des hydrocarbures cycliques, propriétés, exemples »

