Constantes de formules antoine, équations, exemples
- 4993
- 1399
- Noa Da silva
Le Constantes d'Antoine Il existe trois paramètres qui apparaissent dans une relation empirique entre la pression de vapeur de saturation et la température pour les substances pures. Ils dépendent de chaque substance et sont censés être constants dans une certaine gamme de températures.
De cette gamme, les constantes d'Antoine modifient leur valeur. Les constantes sont liées par une équation créée en 1888 par l'ingénieur français Louis Charles Antoine (1825-1897).
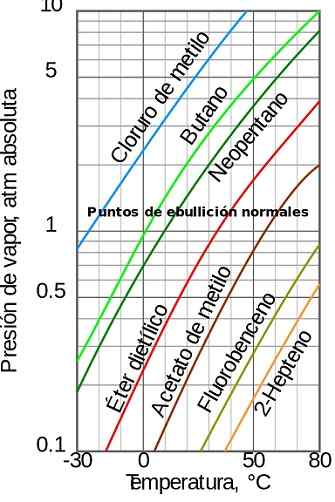
 Figure 1. Pression de vapeur en fonction de la température. Source: Wikimedia Commons
Figure 1. Pression de vapeur en fonction de la température. Source: Wikimedia Commons [TOC]
Formules et équations
La façon la plus habituelle d'exprimer la fonction d'Antoine est:

Dans cette formule P, il représente la pression de vapeur de saturation exprimée en millimètres de mercure (MMHg), t est la température qui est la variable indépendante et est exprimée en ℃.
A, B et C sont les constantes ou paramètres de la formule Antoine.
L'importance de cette formule qui, malgré son empirique, donne une expression analytique simple qui peut être facilement utilisée dans les calculs thermodynamiques.
La formule d'Antoine n'est pas unique, il existe des expressions plus précises qui sont des extensions de cette formule, mais avec l'inconvénient qui ont six paramètres ou plus et leur expression mathématique est plus complexe, ce qui les rend très pratiques à utiliser dans les calculs thermodynamiques.
Vapeur de saturation
Comme la formule d'Antoine mesure la pression de vapeur de saturation, il est nécessaire d'expliquer en quoi il consiste.
Dans un ampoule en verre ou un autre récipient, un liquide est placé. Tout l'air aérien est extrait. L'ensemble est placé dans un bain thermique jusqu'à ce que l'équilibre soit atteint.
Au début, tout est liquide, mais parce qu'il y a un vide, les molécules les plus rapides commencent à abandonner le liquide formant un gaz de la même substance du liquide.
Peut vous servir: mouvement rectiligne uniforme: caractéristiques, formules, exercicesLe processus précédent est le évaporation Et à mesure que la pression de vapeur augmente.
Certaines des molécules de vapeur perdent de l'énergie et reviennent à la phase liquide de la substance, c'est le processus de condensation.
Puis deux processus, l'évaporation et la condensation se produisent simultanément. Lorsque le même nombre de molécules liquides qui y sont incorporées sortent, un équilibre dynamique Et à l'heure actuelle, la pression maximale de vapeur connue sous le nom de pression de saturation se produit.
C'est cette pression de saturation de vapeur qui prédit la formule Antoine pour chaque substance et chaque température.
Dans certains solides, il existe un phénomène similaire lorsqu'il passe de la phase solide vers le soda directement sans passer par la phase liquide, dans ces cas, une pression de vapeur de saturation peut également être mesurée.
Il n'est pas facile d'établir un modèle théorique à partir des premiers principes, car des changements d'énergie cinétique moléculaire sont impliqués, qui peuvent être de type translationnel, rotationnel et vibrationnel, avec l'énergie de liaison moléculaire interne. C'est pour cette raison que dans la pratique, des formules empiriques sont utilisées.
Comment sont la constante d'Antoine?
Il n'y a pas de méthode théorique pour obtenir les constantes d'Antoine, car c'est une relation empirique.
Ils sont obtenus à partir des données expérimentales de chaque substance et ajustant les trois paramètres A, B et C, de sorte qu'ils minimisent la différence quadratique (méthode des minimums carrés) de la prédiction avec les données expérimentales.
Pour l'utilisateur final, qui sont généralement des ingénieurs chimiques, il existe des tableaux dans les manuels de chimie où ces constantes sont données pour chaque substance indiquant les plages de température maximales et minimales dans lesquelles ils sont applicables.
Peut vous servir: Thermomètre de résistance: caractéristiques, fonctionnement, utilisationsDes services en ligne sont également disponibles qui donnent les valeurs des constantes A, B et C, comme c'est le cas de DDBST GmbH Onlines Services.
Pour la même substance, il peut y avoir plus d'une gamme de températures de validité. Ensuite, selon la plage de travail, l'un ou l'autre groupe de constantes est choisi.
Les difficultés peuvent apparaître si la plage de travail de température se situe entre deux plages de validité des constantes, car les prévisions de pression de formule ne coïncident pas dans la zone limite.
Exemples
Exemple 1
Trouvez la pression de vapeur d'eau à 25 ℃.
Solution
Nous avons consulté les tables pour déterminer les constantes d'Antoine.
Il y a deux gammes d'eau:
Entre 1 ℃ et 100 ℃ et entre 99 ℃ à 374 ℃.
Comme nous nous intéressons à 25 ℃, nous prenons la première gamme dans laquelle la valeur des constantes d'Antoine est:
A = 8,07131
B = 1730,63
C = 233 426
P = 10 ^ (8 07131 - 1730.63 / (25 + 233 426))
Calcul de l'exposant
Calcularons d'abord l'exposant: 1 374499
P = 10 ^ 1,374499 = 23 686 mmHg = 0,031166 ATM
L'analyse des résultats
Ces résultats sont interprétés comme suit:
Supposons que de l'eau pure soit placée dans un récipient hermétique auquel l'air a été extrait par une pompe à vide.
Le récipient avec de l'eau est placé dans un bain thermique à une température de 25 ℃ jusqu'à ce que l'équilibre thermique atteigne.
L'eau dans le récipient hermétique s'évapore partiellement jusqu'à ce que la pression de vapeur de saturation soit atteinte, ce qui n'est rien d'autre que la pression dans laquelle l'équilibre dynamique entre la phase liquide de l'eau et la phase de vapeur est établie.
Peut vous servir: modèle atomique de Dirac Jordan: caractéristiques et postulatsCette pression dans ce cas s'est avérée être de 0,031166 atm à 25 ℃.
Exemple 2
Trouvez la pression de vapeur d'eau à 100 ℃.
Solution
Nous avons consulté les tables pour déterminer les constantes d'Antoine. Il y a deux gammes d'eau:
Entre 1 ℃ et 100 ℃ et entre 99 ℃ à 374 ℃.
Dans ce cas, la température d'intérêt se situe dans les deux plages.
Nous utilisons la première des gammes [1 ℃, 100 ℃]
A = 8,07131
B = 1730,63
C = 233 426
P = 10 ^ (8 07131 - 1730.63 / (100 + 233 426))
Calcul de l'exposant
Calculons d'abord l'exposant: 2.8808
P = 10 ^ 1,374499 = 760,09 mmHg = 1 0001 ATM
Ensuite, nous utilisons la seconde des gammes [99 ℃, 374 ℃]
Dans ce cas, les constantes sont
A = 8 14019
B = 1810.94
C = 244.485
P = 10 ^ (8.14019 - 1810.94 / (100 + 244.485))
Calculons d'abord l'exposant: 2.88324
P = 10 ^ 2.88324 = 764.2602 mmHg = 1 0056 ATM
Il y a une différence en pourcentage entre les deux résultats de 0,55%.
Les références
- Application des lois de Raoult et Dalton et l'équation Antoine. Récupéré de: le mien et ancien.Wordpress.com
- Calculatrice en ligne de la formule Antoine. Récupéré de: ddbonline.Ddbst.de / antoincalcion / antoincalcalgilaticgi.exe
- Gecousb. Thermodynamique et tables à vapeur / constante d'Antoine. Récupéré de: gecousb.com.aller
- Propriétés thermiques de la matière. Récupéré de: webserver.Dmt.UPM.est
- Yaws et Yang. Antoine Tables constantes pour plus de 700 composés organiques. Récupéré de: utilisateur.Engin.Umd.Édu
- Wikipédia. Équation Antoine. Récupéré de Wikipedia.com
- Wikipédia. Équation de Clausius-Clapeyron. Récupéré de Wikipedia.com
- Wisniak J. Développement historique de l'équation de pression de vapeur de Dalton Toy Antoine. Récupéré de: lien.Springer.com
- « Calcul de densité relative, exemples, exercices
- Équations de diagramme de mauvaise humeur, à quoi sert-il, applications »

