Caractéristiques des composés quaternaires, formation, exemples
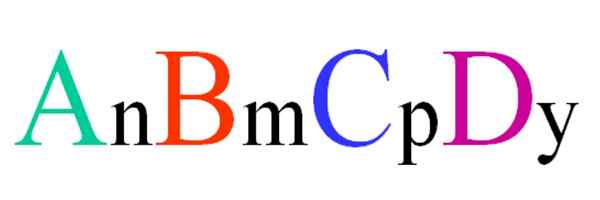
- 3147
- 726
- Noa Da silva
Les Composés quaternaires Ce sont tous ceux qui ont quatre atomes ou ions différents. Par conséquent, ils peuvent être des espèces moléculaires ou ioniques. Ses diversités couvrent la chimie organique et inorganique, étant un groupe très volumineux; Bien que peut-être pas tant par rapport aux composés binaires ou ternaires.
La raison pour laquelle votre nombre est plus petit est que les quatre atomes ou ions doivent être gardés unis par leurs affinités chimiques. Tous les éléments ne sont pas compatibles entre eux, et encore moins lorsqu'ils sont considérés comme un quatuor; Soudain, quelques-uns d'entre eux sont plus liés les uns aux autres qu'avec l'autre paire.
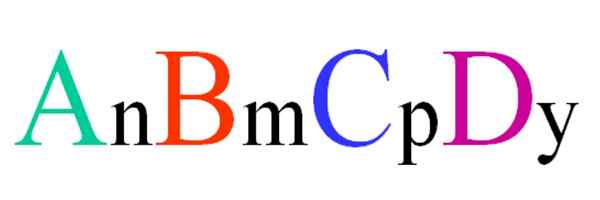 Formule générale et aléatoire pour un composé quaternaire. Source: Gabriel Bolívar.
Formule générale et aléatoire pour un composé quaternaire. Source: Gabriel Bolívar. Considérez un composé quaternaire de la formule aléatoire ABCD. Les indices n, m, p e y, sont les coefficients stœchiométriques, qui à leur tour indiquent quelle proportion de chaque atome il y a par rapport aux autres.
Ainsi, la formule AnBmCpDet Il sera valable s'il rencontre l'électroneutralité. De plus, un tel composé sera possible si leurs quatre atomes sont suffisamment proches les uns avec les autres. On verra que cette formule ne s'applique pas à de nombreux composés, mais surtout pour les alliages ou les minéraux.
[TOC]
Caractéristiques des composés quaternaires
Produits chimiques
Un composé quaternaire peut être ionique ou covalent, présentant les caractéristiques attendues pour sa nature. Les composés ioniques ABCD devraient être solubles dans l'eau, les alcools ou dans d'autres solvants polaires; Ils doivent avoir des points d'ébullition et de fusion élevés et être de bons conducteurs d'électricité lorsqu'ils fusionnent.
En ce qui concerne les composés covalents ABCD, la plupart sont constitués de composés organiques d'azote, oxygénés ou halogénés; c'est-à-dire que sa formule deviendrait CnHmSOITpNet ou cnHmSOITpXet, X étant un atome halogène. De ces molécules, il serait logique de penser qu'ils étaient polaires, compte tenu des électronégativités élevées de O, N et X.
Peut vous servir: chlorure de sodium (NaCl)Un composé ABCD purement covalent peut avoir de nombreuses possibilités de liaison: A-B, B-C, D-A, etc., Selon les affinités et les capacités électroniques des atomes. Alors que dans un composé ABCD purement ionique, ses interactions sont électrostatiques: A+B-C+D-, par exemple.
Dans le cas d'un alliage, considéré comme plus un mélange solide qu'un composé correctement parlant, ABCD se compose d'atomes neutres dans les états basaux (en théorie).
Du reste, un composé ABCD peut être neutre, acide ou basique, selon l'identité de ses atomes.
Physique
Physiquement parlant, il est probable que l'ABCD ne devienne pas un gaz, car quatre atomes différents impliquent toujours une plus grande masse moléculaire ou formulent. S'il ne s'agit pas d'un liquide avec un point d'ébullition élevé, il devrait être un solide, dont la décomposition doit générer de nombreux produits.
Encore une fois, ses couleurs, son odeur, sa texture, ses cristaux, etc., Ils seront soumis à la façon dont ils coexistent A, B, C et D dans le composé, et dépendront de leur synergie et de leurs structures.
Nomenclature
Jusqu'à présent, la question des composés quaternaires a été abordée de manière mondiale et imprécise. Quitter la chimie organique de côté (amidas, chlorures de bancilo, sels d'ammonium quaternaire, etc.), En chimie inorganique, il existe des exemples bien définis appelés oxisaux acides et basiques.
Oxisals acides
Les oxisaux acides sont ceux qui dérivent de la neutralisation partielle d'un oxoacide polyprotique. Ainsi, un ou plusieurs de ses hydrogènes sont remplacés par des cations métalliques, et plus l'hydrogène moins restant possède, moins il sera acide.
Par exemple, acide phosphorique, h3Pote4, Jusqu'à deux sels acides peuvent être obtenus, pour dire, en sodium. Ce sont: non2Pote4 (N / A+ remplace un hydrogène équivalent à H+) et na2HPO4.
Peut vous servir: sélénium: histoire, propriétés, structure, obtention, utilisationsSelon la nomenclature traditionnelle, ces sels sont nommés ainsi que les oxisaux (totalement non protégés), mais précédant le mot «acide» au nom du métal. Ainsi, le Nah2Pote4 Ce serait le phosphate de déase de sodium et le na2HPO4 Phosphate d'acide de sodium (car il a un H.
D'un autre côté, la nomenclature des stocks préfère utiliser le mot «hydrogène» cet «acide». Le non2Pote4 Ce serait d'être du dihydrogène de sodium, et le na2HPO4 Hydrogène sodium phosphate. Notez que ces sels ont quatre atomes: Na, H, P et O.
Oxisaux de base
Les oxisaux de base sont ceux qui contiennent un anion oh dans leur composition-. Par exemple, considérez le Salt Cano3Oh (CA2+ NON3- Oh-). Pour le nommer, il serait suffisant pour donner le mot «de base» au nom du métal. Ainsi, son nom serait: nitrate de calcium de base. Et que diriez-vous de Cuio3Oh? Son nom serait: Cupric Basic Yodato (Cu2+ Io3- Oh-).
Selon la nomenclature des stocks, le mot «basique» est remplacé par l'hydroxyde, suivi par l'utilisation d'un script avant le nom de l'Oxoanion.
Répéter les exemples précédents, leurs noms seraient pour chacun: nitrate d'hydroxyde de calcium et hydroxyde etodate de cuivre (II); Rappelant que le Valencia en métal doit être indiqué entre parenthèses et avec des numéros romains.
Doubles sels
Dans les doubles sels, il y a deux cations différentes interagissant avec le même type d'anion. Supposons le double sel: Cu3Foi (po4)3 (Cu2+ Foi3+ Pote43-). Il s'agit d'un phosphate de fer et de cuivre, mais le nom le plus approprié pour se référer est: Triple Copper (II) et Fer (III) Phosphate.
Sels hydratés
Ce sont des hydrates, et la seule différence est qu'à la fin de leurs noms, le nombre de formulations d'eau est spécifié. Par exemple, le MNCL2 C'est du chlorure de manganèse (II).
Peut vous servir: benzoine: structure, propriétés, utilisations et risquesSon hydrate, mncl2· 4h2O Il est appelé chlorure de manganèse (II) tétrahydrate. Notez qu'il y a quatre atomes différents: Mn, Cl, H et O.
Un sel double et hydraté célèbre est Mohr's, Faith (NH4)2(SW4)2· 6h2SOIT. Son nom est: Double Fer Sulfate (II) et Hexahydrate Ammonium.
Entraînement
Encore une fois, en nous concentrant sur les composés quaternaires inorganiques, nous avons principalement un produit de neutralisations partielles. Si ceux-ci se produisent en présence de plusieurs oxydes métalliques, les doubles sels sont probables; Et si le milieu est très basique, les oxisaux de base précipiteront.
Et si en plus, en revanche, les molécules d'eau ont une affinité pour le métal, elles se coordonneront directement avec elle ou avec les ions environnants, formant les hydrates.
Sur le côté des alliages, quatre métaux ou métalloïdes différents doivent être soudés pour la fabrication de condensateurs, de semi-conducteurs ou de transistors.
Exemples
Enfin, une liste avec différents exemples de composés quaternaires est illustrée ci-dessous. Le lecteur peut l'utiliser pour tester sa connaissance de la nomenclature:
- PBCO3(OH)2
- CR (HSO4)3
- Nahco3
- Znioh
- Cu2(OH)2Swin3
- Li2Kaso4
- Cuso4· 5h2SOIT
- Agau (donc4)2
- Cas4· 2h2SOIT
- Fecl3· 6h2SOIT
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Nomenclature et formulation inorganiques. [PDF]. Récupéré de: Ressources.éducation.est
- Erika Thalîa bien. (2019). Doubles sels. Académie. Récupéré de: Academy.Édu
- Wikipédia. (2019). Cation ammonium quaternaire. Récupéré de: dans.Wikipédia.org

