Structure du chromate de zinc, propriétés, obtenant, utilisations
- 3515
- 59
- Louna Baron
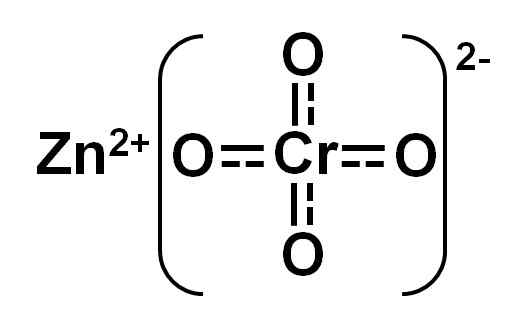
Il chromate de zinc Le chromate de CINC est un composé inorganique formé par les éléments de zinc (Zn), de chrome (CR) et d'oxygène (O) (O). Il a les ions Zn2+ et Cro42-. Sa formule chimique est Zncro4.
Le terme «chromate de zinc» sert commercialement à désigner trois composés avec une structure moléculaire différente: (a) Le chromate de zinc approprié Zncro4, (b) le chromate de base de FIFCRO4• 4ZN (OH)2, et (c) le chromate de base du zinc et de la 3zncro potassium4• Zn (OH)2• k2Cro4• 2h2SOIT.
 Structure de chromate de zinc. Auteur: Marilú Stea.
Structure de chromate de zinc. Auteur: Marilú Stea. Il est principalement utilisé dans les peintures ou les fonds qui protègent les métaux de corrosion. Pour ce faire, il est mélangé à des peintures, des vernis et des polymères qui s'appliquent ensuite à la surface des métaux.
Il est également utilisé dans les finitions décoratives et protectrices obtenues avec d'autres chromates et acides enrobant divers objets tels que des outils. Il sert également à conserver la conductivité électrique des pièces métalliques.
Il est utilisé comme catalyseur dans les réactions d'hydrogénation (ajout d'hydrogène) dans les composés organiques. Cela fait partie des pigments autrefois utilisés dans les peintures artistiques.
C'est un matériau qui produit un cancer et c'est parce que le chromate a un chrome dans l'état d'oxydation +6.
[TOC]
Structure
 Chromate de zincro4 C'est un composé jaune. Auteur: Marilú Stea.
Chromate de zincro4 C'est un composé jaune. Auteur: Marilú Stea. Le chromate de zinc est un composé ionique formé par les quinze cations Zn2+ et l'anion cromato42-. Ce dernier est formé par Chrome avec Valencia +6 (chrome hexavalent, cr6+) et quatre atomes d'oxygène avec l'état d'oxydation -2.
L'ion zn2+ Il a la structure électronique suivante:
12, 2s2 2 P6, 3s2 3p6 3Ddix.
Pour sa part, le chrome hexavalent a dans ses orbitales électroniques la conformation suivante:
12, 2s2 2 P6, 3s2 3p6.
Les deux structures sont très stables car les orbitales sont complètes.
Nomenclature
- Chromate de zinc
- Sel de zinc d'acide chromique
- Jaune zinc (bien qu'avec ce terme d'autres composés contenant du zncro soient également appelés4).
Propriétés
État physique
Citron jaune jaune solide cristallin. Cristaux en forme de prismes.
Poids moléculaire
181,4 g / mol
Point de fusion
316 ºC
Densité
3,40 g / cm3
Solubilité
Eau soluble dans l'eau: 3,08 g / 100 g de h2SOIT. Il est facilement dissous dans les acides et l'ammoniac liquide. Insoluble en acétone.
Peut vous servir: constante d'ionisationpH
Selon certaines sources, leurs solutions aqueuses sont acides.
Propriétés chimiques
C'est un composé fortement oxydant, il peut donc réagir avec des agents réducteurs générant de la chaleur. Parmi les substances avec lesquelles les organiques peuvent réagir, comme les cyanures, les esters et les tiocians. Vous pouvez également attaquer certains métaux.
En solution aqueuse, l'ion chromate présente divers balances en fonction du pH et de la formation de différentes espèces.
Espèces formées par chromate
Au-dessus de pH 6 est présent l'ion cromato42- (jaune); Entre pH 2 et pH 6 sont l'ion hcro en équilibre4- et CR Dichromate2SOIT72- (rouge-orange); à pH moins de 1, l'espèce principale est h2Cro4.
Lorsque le cation de zinc (II) est ajouté à ces solutions aqueuses, le Zncro précipite4.
Les soldes sont les suivants:
HCRO4- ⇔ CRO42- + H+
H2Cro4 ⇔ HCRO4- + H+
Croisement2SOIT72- + H2Ou ⇔ 2 hcro4-
En milieu de base, ce qui suit se produit:
Croisement2SOIT72- + Oh- ⇔ HCRO4- + Cro42-
HCRO4- + Oh- ⇔ CRO42- + H2SOIT
Le zncro4 Il ne réagit pas rapidement avec de l'air ou de l'eau.
Obtention
Il peut être produit en réagissant une boue aqueuse d'oxyde de zinc ou d'hydroxyde avec un sel de chromate dissous puis de neutraliser.
Industriellement, le processus Cronak est utilisé, dans lequel le brouillard métallique est immergé dans une solution de dichromate de sodium (NA2Croisement2SOIT7) et l'acide sulfurique (H2Swin4).
Il peut également être préparé en le précipitant à partir de solutions dans lesquelles il y a des sels de zinc et de chromate dissous:
K2Cro4 + ZNSO4 → Zncro4↓ + k2Swin4
Applications
En protection des métaux
Dans l'industrie métallurgique, il est principalement utilisé dans les peintures de fond (peinture préparatoire ou revêtement initial) appliquée aux métaux, à laquelle il fournit une résistance à la corrosion.
Il est utilisé comme pigment dans les peintures et les vernis, insérés dans la matrice d'un polymère organique.
Ce type de peintures est administré aux tuyaux, aux réservoirs d'huile, aux structures en acier telles que les ponts, les tours de transmission électrique et les pièces automobiles pour inhiber la corrosion.
 Les structures en acier de pont sont peintes avec une base de chromate de zinc avant la peinture finale pour les protéger de la corrosion. Auteur: オギクボ マンサク. Source: Pixabay.
Les structures en acier de pont sont peintes avec une base de chromate de zinc avant la peinture finale pour les protéger de la corrosion. Auteur: オギクボ マンサク. Source: Pixabay. Passivation
Il protège également les composants métalliques recouverts de zinc qui ont été passés à l'aide de chromates métalliques alcalins. La passivation consiste en la perte de réactivité chimique dans certaines conditions environnementales.
Peut vous servir: cellules électrochimiquesCes revêtements servent également de finitions décoratives et pour conserver la conductivité électrique. Ils s'appliquent généralement à des articles quotidiens tels que des outils et peuvent être reconnus par leur couleur jaune.
 Certains outils sont couverts de chromate de zinc. Auteur: Duk. Source: Wikimedia Commons.
Certains outils sont couverts de chromate de zinc. Auteur: Duk. Source: Wikimedia Commons. Comment ça marche
Certains enquêteurs ont constaté que la protection contre la corrosion des métaux effectuée par le fi-chromate pourrait être due au fait qu'il inhibe la croissance des champignons. De cette façon, la détérioration du revêtement de peinture anti-corrosif.
D'autres études indiquent que l'effet anticorrosif pourrait être dû au fait que le composé accélère la formation d'oxydes protecteurs sur les métaux.
 Chromate de zinc fond anticorrosif pour la protection de la surface métallique. 水水 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Chromate de zinc fond anticorrosif pour la protection de la surface métallique. 水水 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Réactions catalyse
Ce composé a été utilisé comme catalyseur dans diverses réactions chimiques, telles que l'hydrogénation du monoxyde de carbone (CO) pour obtenir du méthanol (ch3OH).
Les esters peuvent être convertis en alcools primaires par hydrogénation, en utilisant ce composé pour accélérer la réaction.
Selon certains chercheurs, son action catalytique est due au fait que le solide ne présente pas une structure stoechiométrique, c'est-à-dire qu'elle s'écarte de sa formule Zncro4 Et c'est plutôt:
Zn1 FOISCroisement2-xSOIT4
Ce qui implique qu'il y a des défauts dans la structure qui favorisent énergiquement la catalyse.
Autres applications
Il se trouve dans certains colorants huileux, il sert à imprimer, c'est un agent de traitement de surface, il est appliqué dans les planchers de sols et est un réactif dans les laboratoires chimiques.
Utilisations abandonnées
Depuis les années 40, un dérivé du ZNCRO a été utilisé4, Chromate de zinc et de cuivre, comme fongicide foliaire pour les plantes de pommes de terre.
 Plantes de pape. Auteur: Dirk (Beeki®) Schumacher. Source: Pixabay.
Plantes de pape. Auteur: Dirk (Beeki®) Schumacher. Source: Pixabay. Cette utilisation a déjà été abandonnée par la toxicité et les effets nocifs du composé.
Dans les peintures artistiques du XIXe siècle, la présence de sel de chromate de zinc complexe a été trouvée, le 4Zncro4• k2Ou • 3h2O (chromate de zinc et potassium hydraté), qui est un pigment jaune appelé citron jaune.
Peut vous servir: chlorure de lithium (licl): propriétés, risques et utilisationsDes risques
Bien que ce ne soit pas du carburant, lorsqu'il est chauffé, il émet des gaz toxiques. Peut exploser si vous entrez en contact avec des agents réducteurs ou des matières organiques.
La poussière irrite les yeux et la peau produisant une réaction allergique. Son inhalation provoque une irritation du nez et de la gorge. Il affecte les poumons, provoque le raccourcissement, la bronchite, la pneumonie et l'asthme.
Son ingestion affecte le tube digestif, le foie, les reins, le système nerveux central, produit un effondrement circulatoire et endommage le système immunitaire.
Générateur de cancer
Il s'agit d'un cancérogène confirmé, augmente le risque de cancer pulmonaire et de cavité nasale. Il est toxique pour les cellules (cytotoxiques) et endommage également les chromosomes (génotoxique).
 Le chromate de zinc produit un cancer du poumon et des voies respiratoires. Auteur: Vecteurs d'OpenClipart. Source: Pixabay.
Le chromate de zinc produit un cancer du poumon et des voies respiratoires. Auteur: Vecteurs d'OpenClipart. Source: Pixabay. Il a été déterminé que la toxicité et la cancérogénicité de ce composé sont principalement causées par l'action du chrome dans l'oxydation +6. Cependant, la présence de CINC donne de l'insolubilité au produit et cela influence également les dégâts qu'il produit.
Effets sur l'environnement
Il est très toxique pour les animaux et pour la vie aquatique, provoquant des effets nocifs qui durent dans le temps. Ce chimiste peut être bioacumulate tout au long de la chaîne alimentaire.
Pour toutes ces raisons, les processus impliquant des chromates (chrome hexavalent) sont réglementés par les organisations mondiales de santé et remplacés par des techniques alternatives sans cet ion.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Chromate de zinc. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Xie, H. et al. (2009). Le chromate de zinc intime l'instabilité du chromosome et les ruptures de Strad de DNA Doble dans les cellules LUN humaines. Toxicol Appl Pharmacol 2009 1 février; 234 (3): 293-299. NCBI a récupéré.NLM.NIH.Gouvernement.
- Jackson, R.POUR. et al. (1991). L'activité catalytique et la structure des défauts du chromate de zinc. Catal Lett 8, 385-389 (1991). Lien récupéré.Springer.com.
- Yahalom, J. (2001). Méthodes de protection contre la corrosion. Dans Encyclopedia of Materials: Science and Technology. Récupéré de ScienceDirect.com.
- Stranger-Johannessen, M. (1988). L'effet antimicrobien des pigments dans les peintures de protection contre la corrosion. À Houchton D.R., Eggins, H.SOIT.W. (eds) Biodeterioration 7. Lien récupéré.Springer.com.
- Barrett, un.g.M. (1991). Réduction. Dans la compréhension de la synthèse organique. Récupéré de ScienceDirect.com.
- Jeudi, h.W. et al. (1948). Chromate comme fongicides de pomme de terre. American Potato Journal 25, 406-409 (1948). Lien récupéré.Springer.com.
- Lynch, R.F. (2001). Zinc: alliage, traitement thermochimique, propriétés et applications. Dans Encyclopedia of Materials: Science and Technology. Récupéré de ScienceDirect.com.
- Ramesh Kumar, un.V. Et Nigam, R.K. (1998). Étude de spectroscopie Mössbauer des produits de corrosion sous le premier revêtement contenant des pigments anticorrosifs. J Radioanal Nucl Chem 227, 3-7 (1998). Lien récupéré.Springer.com.
- Otero, V. et al. (2017). Les jaunes de baryum, de zinc et de stontium à la fin du XIXe siècle au 20e siècle des peintures à l'huile. Herit Sci 5, 46 (2017). Récupéré de HeritagesCienceJournal.Springer.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Wikipedia (2020). Chromate de zinc. Récupéré de.Wikipédia.org.
- Wikipedia (2020). Revêtement de conversion de chromate. Récupéré de.Wikipédia.org.
- « Ceinture de feu du Pacifique, caractéristiques, principaux volcans
- Structure du chlorure de zinc (ZNCL2), propriétés, obtention, utilisations »

