Propriétés de chlorure de plomb, structure, utilisations

- 4299
- 1132
- Justine Charpentier
Il chlorure de plomb C'est un sel inorganique dont la formule chimique est PBCLn, Où n est le numéro d'oxydation du plomb. Ainsi, lorsque le plomb est comme +2 ou +4, le sel est PBCL2 ou PBCL4, respectivement. Par conséquent, il existe deux types de chlorures pour ce métal.
Des deux, le PBCL2 C'est le plus important et le plus stable; Pendant que le PBCL4 est instable et moins utile. Le premier est de nature ionique, où le cation pb2+ génère des interactions électrostatiques avec l'anion CL- pour construire un réseau cristallin; Et le second, est covalent, avec des liaisons PB-Cl originaires d'un plomb et du tétraèdre de chlore.
 Aiguilles PBCL2 précipitées. Source: Rrausch1974 [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Aiguilles PBCL2 précipitées. Source: Rrausch1974 [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Une autre différence entre les chlorures de plomb est que PBCL2 C'est un solide de cristaux en forme de verre blanc (image supérieure); Pendant que le PBCL4 C'est une huile jaunâtre qui peut cristalliser à -15ºC. Entrée PBCL2 C'est plus esthétique que le PBCL4.
En plus de la susmention, le PBCL2 On le trouve dans la nature comme le minéral de la cotunite; Pendant que le PBCL4 Non, car il est sensible aux décompositions. En provenance de PBCL4 Vous pouvez obtenir le PBO2, du PBCL2 Ils tirent une variété sans fin de composés organométaliques.
[TOC]
Propriétés
Les propriétés du chlorure de plomb dépendent dans l'essence du nombre d'oxydation du plomb; Puisque, le chlore ne change pas, mais fait la façon dont il interagit avec le plomb. Par conséquent, les deux composés doivent être traités; plomb du chlorure (ii) d'une part, et de chlorure de tête (iv) de l'autre.
-Chlorure de plomb (II)
Masse molaire
278.10 g / mol.
Apparence physique
Cristaux de couleur blanche avec des formes d'aiguille.
Densité
5,85 g / ml.
Point de fusion
501 ° C.
Point d'ébullition
950 ° C.
Solubilité dans l'eau
10,8 g / L à 20 ° C. Il est peu soluble et l'eau doit être chauffée afin qu'une quantité considérable puisse être dissoute.
Il peut vous servir: Hydroxyde de nickel (II): structure, propriétés, utilisations, risquesIndice de réfraction
2 199.
Chlorure de plomb (IV)
Masse molaire
349 012 g / mol.
Apparence physique
Liquide huileux jaunâtre.
Densité
3,2 g / ml.
Point de fusion
-15 ° C.
Point d'ébullition
50 ° C. À des températures plus élevées, il décompose en libérant du chlore gazeux:
PBCL4(s) => pbcl2(S) + CL2(g)
En fait, cette réaction peut être très explosive, donc PBCL est stocké4 Dans l'acide sulfurique à -80 ° C.
Structure
-Chlorure de plomb (II)
Au début, une mention a été faite que le PBCL2 C'est un composé ionique, donc il se compose d'ions PB2+ et cl- qui construisent un cristal dans lequel un rapport PB est établi: Cl égal à 1: 2; C'est-à-dire qu'il y a deux fois plus que les anions CL- Quels cations pb2+.
Le résultat est que des cristaux orthorrombiques sont formés dont les ions peuvent être représentés avec un modèle de sphères et de barres comme dans l'image inférieure.
 Structure de cotunite. Source: Benjah-Bmm27 [domaine public].
Structure de cotunite. Source: Benjah-Bmm27 [domaine public]. Cette structure correspond également à celle du minéral de la cotunite. Bien que les barres soient utilisées pour indiquer une directionnalité du lien ionique, il ne doit pas être confondu avec une liaison covalente (ou du moins purement covalente)).
Dans les cristaux ortorrombiques, le PB2+ (Sphères grilliennes) Il a neuf cl- (sphères vertes) l'entourant, comme s'il était enfermé dans un prisme triangulaire. Pour le complexe de la structure et la faible densité ionique du Pb2+, Les molécules sont difficiles à résoudre le verre; raison pour laquelle il est peu soluble dans l'eau froide.
Molécule de phase gazeuse
Lorsque le cristal ni le liquide ne peuvent résister aux températures élevées, les ions commencent à se vaporiser sous forme de molécules PBCL2 discret; c'est-à-dire avec des liaisons covalentes CL-PB-CL et un angle de 98º, comme s'il s'agissait d'un boomerang. On dit ensuite que la phase gazeuse se compose de ces molécules PBCL2 et pas d'ions transportés par les courants d'air.
Peut vous servir: électronégativitéChlorure de plomb (IV)
Pendant ce temps, le PBCL4 C'est un composé covalent. Parce que? Parce que le cation pb4+ Il est plus petit et a également une plus grande densité de charge d'ions que le PB2+, ce qui provoque une plus grande polarisation du nuage électronique du CL-. Le résultat est qu'au lieu d'une interaction du type ionique PB4+CL-, Le lien covalent PB-CL est formé.
Compte tenu de cela, la similitude entre le PBCL est comprise4 Et, par exemple, le CCL4; Les deux sont présentés comme des molécules individuelles tétraédriques. Ainsi, il s'explique pourquoi ce chlorure de plomb est une huile jaunâtre dans des conditions normales; Les atomes de Cl sont quelques-uns liés les uns aux autres et "glisse" lorsque deux molécules PBCL4 Ils viennent.
Cependant, lorsque la température descend et que les molécules deviennent plus lentes, la probabilité et les effets des dipôles instantanés sont augmentés (PBCL4 Il est apolaire compte tenu de sa symétrie); Et puis, l'huile gèle sous forme de cristaux hexagonaux jaunes:
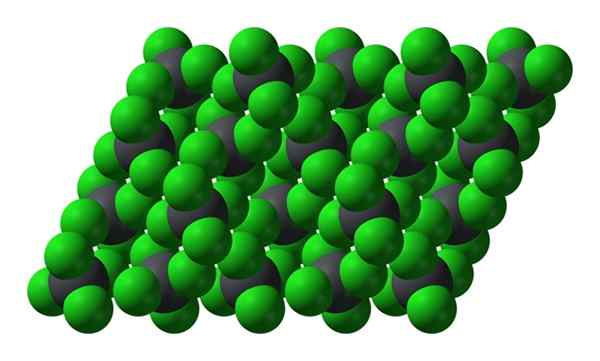 Structure cristalline de PBCL4. Source: Benjah-Bmm27 [domaine public]
Structure cristalline de PBCL4. Source: Benjah-Bmm27 [domaine public] Notez que chaque sphère grisâtre est entourée de quatre sphères vertes. Ces molécules PBCL4 "Squeered" constitue un cristal instable et susceptible de décomposer vigoureusement.
Nomenclature
Les noms: le chlorure de plomb (II) et le chlorure de plomb (iv) correspondent à ceux attribués selon la nomenclature des stocks. Étant donné que le numéro d'oxydation +2 est le plus petit pour le plomb, et +4 le plus grand, les deux chlorures peuvent être nommés selon la nomenclature traditionnelle comme chlorure de plombose (PBCL2), et le chlorure de plúbic (PBCL4), respectivement.
Et enfin est la nomenclature systématique, qui met en évidence le nombre de chaque atome du composé. Ainsi, le PBCL2 C'est le dichlorure de plomb et PBCL4 tétrachlorure de plomb.
Il peut vous servir: impénétrabilité chimiqueApplications
Une utilisation pratique pour PBCL n'est pas connue4 En plus de servir la synthèse PBO2. Cependant, le PBCL2 Il est plus utile et c'est pourquoi seules certaines utilisations de ce chlorure de plomb spécifique seront répertoriées ci-dessous:
- En raison de sa nature très luminescente, il est destiné aux détecteurs photographiques, acoustiques, optiques et de rayonnement.
- N'absorbant pas dans la région du spectre infrarouge, il est utilisé pour la fabrication de verre qui transmet ce type de rayonnement.
- Il a fait partie de ce qu'ils appellent le verre aureno, un matériau attrayant de colorations bleuâtre irisées utilisées à des fins ornementales.
- Aussi, suivant le thème de l'art, lorsque vous êtes atteint, PBCL2· PB (OH)2 acquiert des nuances blanchâtres intenses, en utilisant un pigment de plomb blanc. Cependant, son utilisation a été découragée en raison de sa forte toxicité.
- Mélangé et mélangé avec le barium Titanate, Batio3, originaire de la céramique Titanato du baryum et du ba plomb1 -PBXL'oncle3. Si un PB2+ Entrez dans le batio3, Un ba2+ Vous devez quitter le verre pour permettre son incorporation, et il est ensuite dit qu'un échange de cations se produit; C'est pourquoi la composition du BA2+ Il est exprimé comme 1-x.
- Et enfin, de PBCL2 Plusieurs composés organométaux de la formule générale Rummula sont synthétisés r4PB ou R3PB-PBR3.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Plomb (ii) chlorure. Récupéré de: dans.Wikipédia.org
- Formulation chimique. (2019). Chlorure de plomb (IV). Récupéré de: Formulation Quimica.com
- Clark Jim. (2015). Les chlorures de carbone, de silicium et de plomb. Récupéré de: Chemguide.co.ROYAUME-UNI
- Études non linéaires spectrales et optiques sur le chlorure de plomb (PBCL2) Cristaux. [PDF]. Récupéré de: shodhganga.Infibnet.CA.dans
- Centre national d'information sur la biotechnologie. (2019). Chlorure de plomb. Base de données PubChem; CID = 24459. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- « Propriétés du chlorure de manganèse, structure, utilisations, risques
- COSS DE LA CONFORMATION COMMENT CALUBULTE ET EXEMPLES »

