Propriétés du chlorure de manganèse, structure, utilisations, risques

- 5072
- 609
- Adrien Remy
Il chlorure de manganèse C'est un sel inorganique dont la formule chimique est MCL2. Il se compose d'ions Mn2+ et cl- dans un rapport 1: 2; pour chaque cation mn2+ Il y a deux fois des anions CL-.
Ce sel peut former plusieurs hydrates: mncl2· 2h2Ou, (dihydraté), mcl2· 4h2Ou (tétrahydrate) et mcl2· 6h2Ou (hexahydrate) La forme de sel la plus courante est le tétrahydrate.
 Cristaux de chlorure de manganèse rose. Source: Ondřej Mancgl [domaine public]
Cristaux de chlorure de manganèse rose. Source: Ondřej Mancgl [domaine public] Les propriétés physiques du chlorure de manganèse telles que la densité, la fusion et le point de solubilité dans l'eau sont influencées par leur degré d'hydratation. Par exemple, le point de fusion de la forme anhydrate est beaucoup plus grand que celui de la forme tétrahydrate.
La couleur du chlorure de manganèse est rose pâle (image supérieure). La pâleur est caractéristique des sels de métaux de transition. Le chlorure de manganèse est un acide de Lewis faible.
Le minéral connu sous le nom d'Escacquita est la forme anhydre naturelle de chlorure de manganèse (II); Comme le kempita.
Le chlorure de manganèse (II) est utilisé comme agent en alliage; Catalyseur dans les réactions de chloration, etc.
[TOC]
Propriétés physiques
Aspect physique
- Forme anhydra: cristaux cubiques roses.
- Forme tétrahydrate: cristaux monocliniques rougeâtres légèrement délicats.
Masses molaires
- Anhidro: 125 838 g / mol.
- Dihydared: 161 874 g / mol.
- Tétrahydrate: 197,91 g / mol.
Points de fusion
- Anhidro: 654 ºC.
- Dihydrared: 135 ºC.
- Tétrahydrate: 58 ºC.
Point d'ébullition
Forme anhidra: 1.190 ºC.
Densités
- Anhydre: 2 977 g / cm3.
- Dihydrare: 2,27 g / cm3.
- Tétrahydrate: 2,01 g / cm3.
Solubilité dans l'eau
Formulaire anhydra: 63,4 g / 100 ml à 0 ºC; 73,9 g / 100 ml à 20 ºC; 88,5 g / 100 ml à 40 ° C; et 123,8 g / 100 ml à 100 ° C.
Solubilité dans les solvants organiques
Soluble dans la pyridine et l'éthanol, insoluble dans l'éther.
Décomposition
À moins que des précautions dues ne soient prises, la déshydratation des formes hydratées à une forme anhydre peut provoquer une déshydratation hydrolytique, avec la production de chlorure d'hydrogène et d'oxychlorure de manganèse.
pH
Une solution de 0,2 m de chlorure de manganèse tétrahydraté en solution aqueuse a un pH de 5,5.
Peut vous servir: chromatogrammeLa stabilité
Il est stable, mais sensible à l'humidité et incompatible avec des acides forts, des métaux réactifs et du peroxyde d'hydrogène.
Structure de chlorure de manganèse
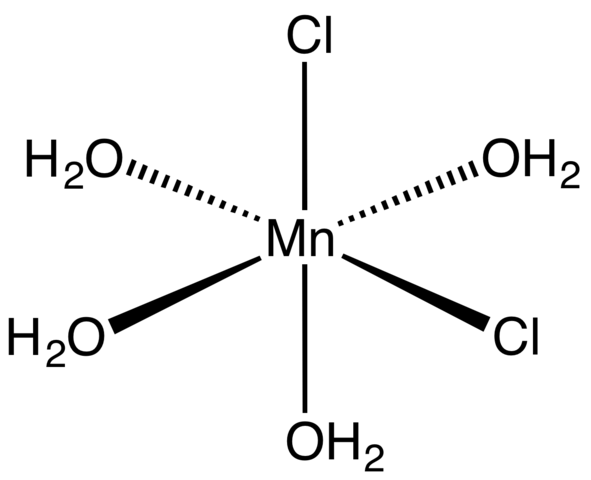 Complexe de coordination pour MNCL2 Tetrahydrate. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Complexe de coordination pour MNCL2 Tetrahydrate. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] En commençant par des cristaux de sel tétrahydraté, rose et frappant, il doit être composé de complexes de coordination (image supérieure). En eux, le centre métallique MN2+ est entouré d'un octaèdre défini par quatre molécules H2Ou et deux anions CL-.
Notez que les ligands CL- Ils sont dans des positions CIS; Tous sont équivalents dans la base rectangulaire de l'Octaedro, et peu importe si le CL est "déplacé"- à l'une des trois autres positions. Un autre isomère possible pour cette molécule coordonnée est dans lequel les deux Cl- Ils sont en positions trans; c'est-à-dire à différentes extrémités (l'une ci-dessus et l'autre ci-dessous).
Les quatre molécules d'eau avec leurs ponts d'hydrogène permettent à deux octaèdres ou plus de se joindre aux forces dipol-dipolo. Ces ponts sont très directionnels et ajoutant les interactions électrostatiques entre le Mn2+ et cl-, Ils établissent une structure ordonnée caractéristique d'un cristal.
La couleur rose du MNCL2· 4h2Ou est dû aux transitions électroniques du Mn2+ et sa configuration D5. De même, les perturbations causées par le voisinage des molécules d'eau et des chlorures modifient la quantité nécessaire d'énergie que ces électrons doivent absorber5 Pour parcourir des niveaux d'énergie plus élevés.
Dihydrate
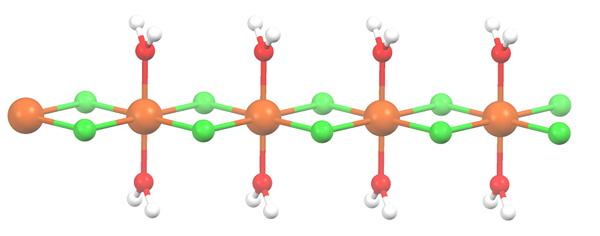 Structure polymère pour mncl2 · 2H2O. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Structure polymère pour mncl2 · 2H2O. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Le sel s'est déshydraté et sa formule devient maintenant MCL2· 2h2SOIT. Qu'arrive-t-il à l'octaèdre antérieur? Rien, sauf que les deux molécules H2Ou qu'ils ont abandonné sont remplacés par deux cl-.
Au début, vous pouvez donner la mauvaise impression qu'il y a quatre CL- pour chaque MN2+; Cependant, la moitié de l'octaèdre (axialement) est en fait l'unité répétitive du verre.
Ainsi, il est vrai qu'il y a un Mn2+ coordonné à deux cl- et deux molécules d'eau en positions trans. Mais pour que cet appareil interagisse avec un autre, il a besoin de deux ponts CL, ce qui permet à son tour l'octaèdre de coordination pour le manganèse.
Peut vous servir: éléments diatomiquesEn plus des ponts CL, les molécules d'eau collaborent également avec leurs ponts d'hydrogène afin que cette chaîne MNCL2· 2h2Ou ne désarmez pas.
Anhydre
Enfin, le chlorure de magnésium a fini de perdre toute l'eau contenue dans ses cristaux; Vous avez du sel d'anhydra maintenant, mcl2. Sans les molécules d'eau, les cristaux perdent considérablement l'intensité de leurs colorations roses. L'octaèdre, comme pour les hydrates, reste inchangé par la nature du manganèse elle-même.
Sans molécules d'eau, le Mn2+ extrémités entourées d'un octaèdre composé uniquement de Cl-. Ce lien de coordination a un caractère covalent et ionique; Pour cette raison, il se réfère généralement à la structure du MNCL2 comme un cristal polymère. Il y a des couches alternatives de Mn et Cl.
Nomenclature
Le manganèse a de nombreux états d'oxydation possibles. Pour cette raison, la nomenclature traditionnelle du MNCL2 Ce n'est pas clarifié.
D'un autre côté, le chlorure de manganèse correspond à son nom le plus connu, auquel il lui manquerait d'ajouter le «(ii)» afin qu'il soit selon le stock de nomenclature: le chlorure de manganèse (II). Et Aseçi, est la nomenclature systématique: le dichlorure de manganèse.
Applications
Laboratoire
Le chlorure de manganèse sert de catalyseur de chloration des composés organiques.
Industrie
Le chlorure de manganèse est utilisé comme matière première pour l'élaboration des anti-artisantes pour l'essence; Matériel de soudage pour les métaux non ferreux; intermédiaire en élaboration des pigments; Et boisson à l'huile de linaza.
Il est utilisé dans l'industrie textile pour l'impression et la teinte; Dans la production de plusieurs sels de manganèse, y compris le tricarbonil du méthylciclopentadienilmanmanais utilisé comme colorant en brique; et dans la production de batteries électriques séchées.
Le chlorure de manganèse est utilisé comme agent en alliage et est ajouté au magnésium fondu pour produire des alliages de manganèse-magnésium; comme intermédiaire dans la préparation des agents de séchage pour la peinture et le vernis; et comme composante des désinfectants.
Peut vous servir: hydroxyde de sodium (NaOH): structure, propriétés, utilisations, synthèseIl est également utilisé dans la purification du magnésium.
Engrais et alimentation animale
Le chlorure de manganèse est utilisé comme source d'élément de manganèse, qui, bien qu'il ne soit pas un élément nutritionnel primaire pour les plantes telles que l'azote, le phosphore et le potassium, est utilisé dans de nombreuses réactions biochimiques de ces êtres vivants de ces êtres vivants.
Il ajoute également à l'alimentation des animaux reproducteurs pour l'approvisionnement en manganèse, un oligoement essentiel pour la croissance des animaux.
Le chlorure de manganèse est un composant alimentaire qui fournit du manganèse, un élément qui intervient dans de nombreux processus nécessaires à la vie, notamment: la synthèse des acides gras et des hormones sexuelles; assimilation de la vitamine E; production de cartilage; etc.
Des risques
Il peut produire par contact avec des rougeurs cutanées, une irritation et une dermatite d'exposition prolongée. Le chlorure de manganèse provoque des rougeurs, des douleurs et des déchirures.
Par inhalation, la cause du sel, le mal de gorge et le manque de respiration. D'un autre côté, l'ingestion pourrait se produire des vomissements, des nausées et de la diarrhée.
L'inhalation chronique excessive de ce sel peut entraîner une inflammation pulmonaire et une maladie réactive ultérieure des voies respiratoires.
Son ingestion excessive peut provoquer des troubles mentaux, une déshydratation, une hypotension, une insuffisance hépatique et rénale, une défaillance du système multiorganique et une mort.
La neurotoxicité est la manifestation initiale de l'action indésirable du manganèse, pouvoir présenter des maux de tête, des étourdissements, une perte de mémoire, une hyperréflexie et des tremblements doux.
La toxicité sévère se manifeste par des symptômes et des signes similaires à ceux observés dans la maladie de Parkinson.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Chlorure de manganèse (ii). Récupéré de: dans.Wikipédia.org
- Nanomatériaux de printemps. (2016). Poudre de chlorure de manganèse. Récupéré de: ssnano.com
- Livre chimique. (2017). Chlorure de manganèse. Récupéré de: Chemicalbook.com
- Réseau de données toxicologie. (s.F.). Chlorure de manganèse. Toxyt. Récupéré de: toxnet.NLM.NIH.Gouvernement
- Gérard Cahiz. (2001). Chlorure de manganèse (ii). est ce que je.org / 10.1002 / 047084289X.RM020
- Centre national d'information sur la biotechnologie. (2019). Dichlorure de manganèse. Base de données PubChem. CID = 24480. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Webconsultas Healthcare, s.POUR. (2019). Minéraux: manganèse. Récupéré de: consultas Web.com
- « Structure de cobalt, propriétés, applications
- Propriétés de chlorure de plomb, structure, utilisations »

