Chlorure d'aluminium (ALCL3)

- 2017
- 548
- Adam Mercier
 Formule et structure du chlorure d'aluminium
Formule et structure du chlorure d'aluminium Qu'est-ce que le chlorure d'aluminium?
Il chlorure d'aluminium C'est un composé chimique inorganique dont la formule est alcl3. Il est présenté comme une poussière solide ou blanche, bien qu'en raison d'une contamination par du chlorure ferrique et de l'humidité, il peut devenir jaune. Il se compose d'un acide Lewis, mais dans certaines circonstances, il se comporte également comme une base de Lewis.
Malgré l'aluminium comme métal dans le tableau périodique, il existe une liaison covalente entre l'aluminium et le chlore pour former du chlorure d'aluminium.
Cette liaison covalente pourrait expliquer pourquoi le chlorure d'aluminium fondu est un mauvais conducteur d'électricité; Tandis que les sels en fusion d'autres composés, comme le chlorure de sodium, sont de bons conducteurs d'électricité.
Le chlorure d'aluminium est produit par une réaction exothermique entre l'aluminium et le chlore, ou chlorure d'hydrogène, à une température comprise entre 650 et 750 ºC.
Le chlorure d'aluminium est utilisé comme antitranspirant et pour lutter contre la transpiration excessive. L'un de ses dérivés est utilisé comme agent coagulant dans le traitement des eaux usées industrielles et est également utilisé comme principal catalyseur dans les réactions chimiques de l'industrie.
Structure de chlorure d'aluminium
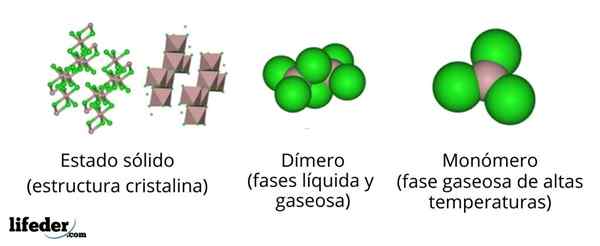
Dans l'image supérieure, nous avons des représentations différentes pour chacune des structures cristallines ou moléculaires qui présentent le chlorure d'aluminium anhydre, alcl3, Dans plusieurs de ses états physiques.
L'alcl3 Solide se compose d'une structure cristalline monoclinique formée par des couches d'octaedros coordonnées les unes avec les autres. Dans ces octaèdres (couleur brune), l'ion à3+ Il est coordonné avec six cltins-, Des chlorures d'acteur comme ponts entre deux octaèdres.
Lorsque la température augmente et que le ALLL est fondé3, Les couches sont séparées en unités à la2CL6 (Centre d'image). Maintenant, l'atome en aluminium forme des liens avec trois atomes de chlore et un lien avec l'autre atome d'aluminium: CL3Al-alcl3. Ces dimères expliquent pourquoi l'ALCL3 La fusion est moins dense que ses cristaux.
Peut vous servir: gadolinio: structure, propriétés, obtention, utilisationsDans la phase de vapeur, les dimères du2CL6 Ils se distancaient les uns les autres. Mais si cette vapeur est soumise à des températures élevées, le dimère se dissocie dans les unités moléculaires alcl3, dans lequel l'atome en aluminium forme trois liens avec les atomes de chlore. L'alcl3 présente une géométrie plate trigonale.
Propriétés du chlorure d'aluminium
 Échantillon solide de chlorure d'aluminium avec des tons jaunâtres. Source: Xlollitox, CC par 3.0, via Wikimedia Commons
Échantillon solide de chlorure d'aluminium avec des tons jaunâtres. Source: Xlollitox, CC par 3.0, via Wikimedia Commons Formules
ALCL3 (anhydre)
ALCL3· 6h2O (hexahydrate)
Masse molaire
133.34 g / mol (anhydro)
241.43 g / mol (hexahydrate)
Apparence physique
Poussière essentielle ou blanche cristalline. Il peut devenir une teinte jaunâtre en raison de la contamination par le chlorure ferrique. Vous pouvez également passer à une couleur grisâtre pour l'humidité.
Point de fusion
192.4 ºC
Point d'ébullition
Sublima à 178 ºC, il n'est donc pas facile d'obtenir le point d'ébullition du chlorure d'aluminium.
Densité
2.48 g / cm3 (anhydre)
2.398 g / cm3 (Hexahydrate)
Solubilité dans l'eau
439 g / L A 0 ºC
458 g / L à 20 ºC
466 g / L A 30 ºC
Le chlorure d'aluminium est un composé hygroscopique qui peut absorber l'eau de l'air humide, émettant une fumée pendant le processus.
Solubilité dans d'autres solvants
Éthanol soluble, chloroforme, tétrachlorure de carbone, benzofénone et nitrobenzène. Légèrement soluble dans le benzène.
La pression de vapeur
13.3 kPa à 151 ºC (0.131 atm).
Gelée
0.35 cp à 197 ºC
Réactivité
Le chlorure d'aluminium est une substance amphotate, c'est-à-dire qu'elle se comporte comme un acide ou une base. Cependant, son action en tant qu'acide est prépondérante, car le chlorure d'aluminium est utilisé comme acide Lewis et est en même temps un catalyseur dans de nombreuses réactions chimiques; Parmi eux, la réaction de Friedel-Crafts.
Peut vous servir: néodyme: structure, propriétés, utilisationsMême le chlorure d'aluminium est classé comme un acide, au lieu de le faire comme un sel.
Le chlorure d'aluminium anhydre en solution aqueuse est transformé en sel hexahydrate (alcl3· 6h2O), qui ne revient pas à la forme anhydre en réchauffant.
Atomes en aluminium de deux molécules ALCL3 Ils interagissent les uns avec les autres pour compléter 8 électrons dans leur couche de valence, ce qui entraîne la formation du dimère au2CL6. Ce dimère est présent dans le chlorure d'aluminium fondu et la vapeur.
Le chlorure d'aluminium réagit avec l'hydroxyde de sodium pour former de l'hydroxyde d'aluminium, un précipité gélatineux:
ALCL3 + Naoh → Al (OH)3 + 3 NaCl
Applications de chlorure d'aluminium
Antitranspirant et antihémorragique
 Le chlorure d'aluminium fait partie des ingrédients utilisés dans les formulations de plusieurs déodorants. Source: Th145, CC BY-SA 2.0, via Wikimedia Commons
Le chlorure d'aluminium fait partie des ingrédients utilisés dans les formulations de plusieurs déodorants. Source: Th145, CC BY-SA 2.0, via Wikimedia Commons Le chlorure d'aluminium est utilisé comme antitranspirant dans les déodorants personnels et est également utilisé pour contrôler la transpiration excessive (hyperhidrose). Il est également utilisé dans les formulations pour contrôler les petits saignements, comme ceux présentés dans les traitements dentaires.
Traitement des eaux usées
Le chlorure d'aluminium sous forme de PAC (chlorure de polyalumine) est utilisé comme coagulant dans le traitement des eaux usées industrielles, en raison de sa capacité à clarifier l'eau et les boues de déshydrate.
Catalyseur
Le chlorure d'aluminium est l'un des principaux catalyseurs utilisés dans l'industrie, agissant comme catalyseur dans de nombreuses réactions, notamment Friedel-Crafts.
Peut vous servir: Europium: structure, propriétés, obtention, utilisationsLe chlorure d'aluminium catalyse les réactions de préparation des antraquinones, dont certaines sont utilisées dans l'industrie textile. Il existe également des antraquinones qui ont des propriétés antibactériennes, antiparasites, fongicides et antivirales.
Le chlorure d'aluminium catalyse les réactions produites par le dodécilbenzène, utilisées dans la production de détergents et l'éthylbenzène, composé utilisé dans la fabrication de polystyrène, polymère utilisé dans l'élaboration des plastiques, des résines et du caoutchouc.
Le chlorure d'aluminium est également utilisé comme catalyseur dans une réaction qui fait partie de la production d'essence à haute octane. De même, catalyse le processus de fissuration à l'huile.
Des risques
Le chlorure d'aluminium est une substance corrosive et son contact peut provoquer une irritation et des blessures à la peau et aux yeux, produisant des dommages oculaires.
Lors de la dissolution dans l'eau, les gaz toxiques peuvent être libérés, comme le chlorure d'hydrogène; des gaz capables d'inhaler une irritation du nez et de la gorge, pouvoir provoquer une irritation dure et pulmonaire. Cette irritation peut conduire à l'accumulation de liquide dans les poumons (œdème pulmonaire), qui se termine par une urgence médicale.
Il a tenté d'établir un lien entre la maladie d'Alzheimer et le chlorure d'aluminium; Bien que les résultats de la recherche ne soient pas concluants.
De même, le lien entre l'utilisation de déodorants qu'ils utilisent comme anti-transpirant à l'ALLL a été étudié3 et cancer du sein. La recherche n'a pas été en mesure de démontrer une relation concluante. Dans tous les cas, le chlorure d'aluminium bloque le fonctionnement d'un système de détoxification naturel de l'organisme et des émissions de chaleur, comme la sueur.
Les références
- Wikipédia. (2021). Chlorure d'aluminium. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie (2021). Chlorure aluminium, Résumé des composés de pubchem pour CID 24012. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- NJ Santé. (2008). Fiche d'information sur la substance dangereuse: chlorure d'aluminium. [PDF]. Récupéré de: NJ.Gouvernement
- Britannica Encyclopaedia. (2021). Chlorure d'aluminium. Récupéré de: Britannica.com
- Elsevier B.V. (2021). Anthraquinones. ScienceDirect. Récupéré de: ScienceDirect.com
- John P. Cunha. (02 mai 2020). Chlorure topique en aluminium. Récupéré de: rxlist.com

