Structure de citrate de sodium (C6H5O7NA3), utilisations, propriétés
- 2638
- 584
- Adam Mercier
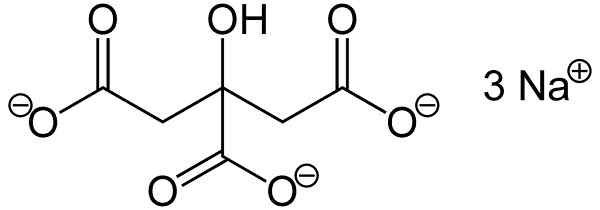
Il citrate de sodium C'est le sel de sodium de l'acide citrique. Il est formé par un citrate anion C6H5SOIT73- et trois cations de sodium+. Sa formule moléculaire est C6H5SOIT7N / A3 ou dans sa forme élargie: naOOC-ch2-C (agone) (oh) -ch2-Chemin. Le citrate de sodium est la base conjuguée de l'acide citrique, c'est-à-dire que ce dernier est obtenu de ce dernier en remplaçant chaque proton h+ de -cooh pour un hochement de tête de sodium+.
Il peut être préparé dans l'anhydra (sans eau dans sa composition) ou dans sa forme hydratée avec 2 ou 5 molécules d'eau. C'est un composé que lorsque l'anhydre (sans eau) a tendance à absorber l'eau de l'environnement.
 Molécule de citrate de trisodium. Auteur: Marilú Stea.
Molécule de citrate de trisodium. Auteur: Marilú Stea. Le citrate de sodium agit comme un tampon, cela signifie que le pH se stabilise, qui est une mesure de l'acidité ou de la basicité d'une solution aqueuse. Il a également la propriété de former un composé stable avec des ions calcium CA2+, Citrate de calcium.
Il est utilisé dans l'industrie alimentaire, par exemple, pour éviter que les formes de lait de vache soient difficiles à digérer par les nourrissons.
Dans les laboratoires de bioanalyse, il est utilisé pour éviter de coaguler le sang que les patients sont extraits pour certains tests. Il l'empêche également de coaguler le sang utilisé dans les transfusions. Il est largement utilisé dans les détergents sans phosphate car il ne peut pas polluer.
[TOC]
Structure
Le citrate de trisodio est composé de trois ions de na du sodium+ et un ion citrate.
L'ion citrate est composé d'une chaîne de trois atomes de carbone auxquels 3 carboxylates sont unis- (un pour chaque atome de carbone) et un hydroxyl -OH dans le carbone central.
Chacun des 3 ions Na+ est lié à un groupe -coo-.
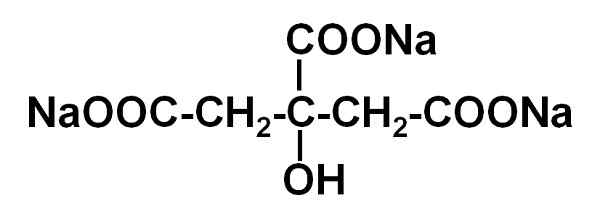
 Structure du citrate de trisodium. Jü [domaine public]. Source: Wikimedia Commons.
Structure du citrate de trisodium. Jü [domaine public]. Source: Wikimedia Commons. Nomenclature
- Citrate de sodium
- Citrate de trisodio
- 2-hydroxipropane-1,2,3-tricarboxylate trisodium
Propriétés
État physique
Solide cristallin blanc ou incolore.
Poids moléculaire
258,07 g / mol
Point de fusion
300 ºC
Solubilité
Il est très soluble dans l'eau: 42,5 g / 100 ml à 25 ºC. C'est pratiquement insoluble dans l'alcool.
pH
Une solution aqueuse à 5% de citrate de sodium a un pH entre 7,5 et 9,0, c'est-à-dire qu'elle est légèrement alcaline.
Propriétés chimiques
Le citrate de sodium est un tampon, ce qui signifie que stabilise le pH, qui est une mesure de l'acidité ou de l'alcalinité d'une solution aqueuse. Citrate lors de la stabilisation du pH ne permet pas à la solution d'être acidifiée ou alcalisée au-dessus de certaines valeurs.
Peut vous servir: Configuration électronique du noyau: construction, exemplesQuand il y a des excès de protons H+ Je les prends pour convertir leurs groupes -coo- En groupes -coh. Vice versa, s'il y a beaucoup de groupes OH- donne les protons de leurs groupes -coh et les fait -coo-.
Lorsqu'il est transformé par le corps, il fournit 3 molécules HCO3- Pour chaque molécule de citrate.
Autres propriétés
Ses cristaux sont délicieux, c'est-à-dire qu'ils absorbent l'air de l'air. Le citrate de sodium dihydraté est plus stable dans l'air.
Si le dihydrate est chauffé, lorsqu'il atteint 150 ºC, il devient anhydre (sans eau).
Comme l'acide citrique, le citrate de sodium a un goût aigre.
Obtention
Le citrate de sodium est généralement obtenu en ajoutant du carbonate de sodium à une solution d'acide citrique jusqu'à ce que l'efficacité cesse. L'éfervescence est due au détachement du dioxyde de carbone2:
N / A2CO3 + Acide citrique → citrate de sodium + CO2↑
Ensuite, l'eau de la solution s'évapore pour cristalliser le produit.
Il peut également être préparé en traitant une solution de sulfate de sodium avec du citrate de calcium:
N / A2Swin4 + Citrate de calcium → citrate de sodium + cas4↓
La solution est filtrée pour supprimer le boîtier4 Solide qui a précipité. Alors la solution est concentrée et cristallise ainsi le citrate de sodium.
Emplacement dans la nature
Le citrate de sodium est la base conjuguée de l'acide citrique, qui est un composé naturel trouvé dans tous les organismes vivants car il fait partie de son métabolisme, qui est le mécanisme pour développer l'énergie dans les cellules.
Applications
Dans l'industrie alimentaire
Le citrate de sodium a diverses utilisations dans l'industrie alimentaire, par exemple, en tant que régulateur de l'acidité, de l'enlèvement, du stabilisateur, de l'agent de surfactant ou de l'émulsifiant.
Il est utilisé dans les boissons, les desserts congelés et les fromages spéciaux, entre autres produits.
Il permet d'éviter la coagulation du lait, il est donc ajouté au lait de vache utilisé pour l'alimentation des nourrissons. De cette façon, aucun coagle ou boucles dur-digest n'est créé par l'estomac des petits.
 Vous pouvez ajouter du citrate de sodium au lait afin que les morceaux ne soient pas formés dans l'estomac. Auteur: Couleur. Source: Pixabay.
Vous pouvez ajouter du citrate de sodium au lait afin que les morceaux ne soient pas formés dans l'estomac. Auteur: Couleur. Source: Pixabay. Il est utilisé pour accélérer la fixation des couleurs dans les viandes de porc ou les vaccins durcis, c'est-à-dire la viande traitée pour éviter sa décomposition. Jusqu'à 50% d'acide ascorbique est remplacé dans ces.
Peut vous servir: acide silicite Viande de porc sérigraphiée qui contient probablement du citrate de sodium. Auteur: Ben Kerckx. Source: Pixabay.
Viande de porc sérigraphiée qui contient probablement du citrate de sodium. Auteur: Ben Kerckx. Source: Pixabay. Il sert également à prévenir la coagulation sanguine dans la viande de vaccin frais (comme les steaks).
En médecine
Il est utilisé comme agent alcalissant, car neutralise l'excès d'acide dans le sang et l'urine. Il est indiqué pour traiter l'acidose métabolique qui se produit lorsque le corps produit trop acide.
Une fois l'ion citrate ingéré, il devient un ion bicarbonate qui est un agent alcalisant systémique (c'est-à-dire le corps entier) et en conséquence les ions H neutralisent+, Augmente le pH du sang et revient ou élimine l'acidose.
Le citrate de sodium sert d'agent neutralisant pour l'inconfort de l'estomac.
Il est utilisé comme expectorant et sueur. Il a une action diurétique. Augmentez l'excrétion urinaire du calcium, qui est utilisée dans l'hypercalcémie, c'est-à-dire lorsqu'il y a un excès de calcium dans le sang.
Il sert également à faciliter l'élimination du plomb lors de l'empoisonnement avec ce métal.
Si un excès est administré, l'alcalose peut être produite, les spasmes musculaires dus.
Le citrate de sodium est utilisé dans les transfusions. Il est ajouté au sang avec dextrose pour éviter sa coagulation.
 Blood stocké pour les transfusions. Contient probablement du citrate de sodium. Auteur: Kshirl02. Source: Pixabay.
Blood stocké pour les transfusions. Contient probablement du citrate de sodium. Auteur: Kshirl02. Source: Pixabay. Normalement, le foie métabolise rapidement le citrate obtenu dans la transfusion, cependant, lors des transfusions de grandes quantités, la capacité hépatique peut être dépassée.
Dans de tels cas, puisque le citrate forme un complexe avec du calcium, il s'agit d'une diminution de l'ion calcium CA2+ Dans le sang. Cela peut générer des étourdissements, des tremblements, des picotements, etc. Par conséquent, les transfusions doivent être effectuées lentement.
Dans l'industrie pharmaceutique
Parmi de nombreuses autres utilisations, il est utilisé pour empêcher l'assombrissement des médicaments dans lesquels il y a du fer et des tanins.
En analyse sanguine
Il est utilisé comme anticoagulant dans la collecte de sang ou lorsqu'il doit être stocké, car il agit comme un coffre à ions calcium2+, c'est-à-dire qu'il se lie aux ions calcium formant du citrate de calcium qui n'est pas ionisé.
Peut vous servir: lien ionique: caractéristiques, comment elle est formée et des exemplesIl est utilisé dans les tests de coagulation et pour déterminer la vitesse de sédimentation des globules rouges.
 Analyse de sang. Auteur: Bokskopet. Source: Pixabay.
Analyse de sang. Auteur: Bokskopet. Source: Pixabay. Il est utilisé comme anticoagulant pendant la plasmaphérèse, procédure pour extraire des substances excessives sanguines nocives pour le corps.
Dans la synthèse des nanoparticules
Il est utilisé comme stabilisateur dans la synthèse des nanoparticules d'or. Trisodio citrate dihydraté à l'acide chloroahique est ajouté, formant une suspension de vin rouge.
Le citrate de sodium sert d'agent réducteur et d'agent anti-registre, car il est adsorbé sur les nanoparticules.
En raison de la charge négative du citrate, les particules en repoussent une. Plus la plus petite concentration en citrate est élevée.
Ces nanoparticules servent à préparer des biocapteurs médicaux.
Dans les détergents environnementaux
Le citrate de sodium est largement utilisé dans les détergents liquides sans phosphate. C'est parce que son comportement environnemental est inoffensif car il s'agit d'un métabolite trouvé dans tous.
Il est facilement biodégradable et faiblement toxique pour la vie aquatique. Pour cette raison, il est considéré qu'il s'agit d'un agent de nettoyage avec des caractéristiques écologiquement favorables.
En améliorant l'exploitation de sables bitumineux
Les sables bitumineux sont des formations sablonneuses riches en bitume ou goudron, un matériau similaire à l'huile.
Le citrate de sodium a été testé avec succès avec l'hydroxyde de sodium NaOH pour extraire l'huile de sables bitumineux.
On pense que lorsque le citrate avec le grès, les ions -coo- de citrate forment un grand nombre de charges négatives sur les particules de silice. Cela produit une meilleure séparation du sable du bitume par la simple répulsion des charges négatives du gravier des charges négatives du bitume.
Dans d'autres applications
Il est utilisé en photographie, pour éliminer les métaux de trace, en électrodiffusion et pour enlever ainsi2 de gaz résiduels.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Citrate de sodium. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- McNamara, C. (2017). Collecte et manipulation du sang. Dans DACIE et LEWIS Hématologie pratique (douzième édition). Récupéré de ScienceDirect.com.
- Steber, J. (2007). L'écotoxicité du nettoyage des ingrédients du produit. Dans Handbook for Cleaning / Decontamination of Surfaces. Récupéré de ScienceDirect.com.
- Xiang, b. et al. (2019). Étude du rôle du citrate de sodium dans la libération du bitume. Energy Fuels 2019, 33, 8271-8278. Récupéré des pubs.ACS.org.
- Heddle, n. Et Webert, K.ET. (2007). Transfusion de médecine. En médecine de la banque sanguine et transfusion (deuxième édition). Récupéré de ScienceDirect.com.
- Sudhakar, s. et Santhosh, P.B. (2017). Nanomatériaux d'or. Dans les progrès des biomembranes et des lipides. Récupéré de ScienceDirect.com.
- Elsevier (éditorial) (2018). Chapitre 8. Nanométal. Dans les fonds et les applications de Nano Silicon en plasmonics et Fullines. Tendances actuelles et futures Micro et Nano Technologies. Pages 169-203. Récupéré de ScienceDirect.com.

