Acide propanoïque
- 3988
- 1163
- Adrien Remy
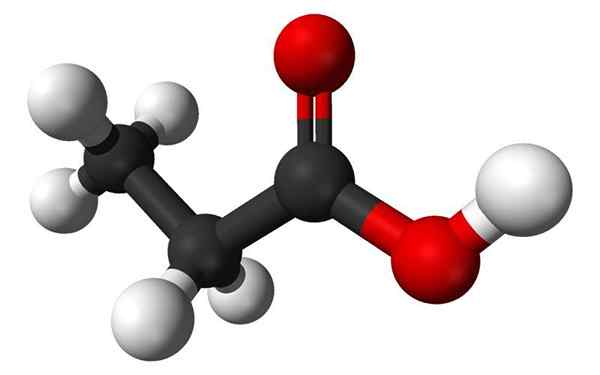
 Molécule d'acide propanoïque dans un modèle de barre et de sphères. Source: Benjah-Bmm27, Wikimedia Commons
Molécule d'acide propanoïque dans un modèle de barre et de sphères. Source: Benjah-Bmm27, Wikimedia Commons Qu'est-ce que l'acide propane?
Il Acide propanoïque, Également appelée propionique, il s'agit d'un acide gras à courte chaîne saturé qui comprend de l'éthane attaché au carbone d'un groupe carboxy. Sa formule est Cho3-Ch2-COOH.
L'anion CH3CH2COO, ainsi que les sels et les esters de l'acide propanique, sont appelés proportion (ou propanoats).
Il peut être obtenu à partir de résidus en pâte en bois par processus de fermentation, en utilisant des bactéries de genre Propionibacterium. Il est également obtenu à partir d'éthanol et de monoxyde de carbone, en utilisant un catalyseur de trifluoride de bore.
Une autre façon d'obtenir de l'acide propane est due à l'oxydation d'une proportion en présence d'ions cobalt ou manganèse. Cette réaction se développe rapidement à des températures aussi basses que 40-50 ° C:
2ch3Ch2Cho + o2 → 2ch3Ch2COOH
Le composé est naturellement présent à de faibles niveaux dans les produits laitiers et se produit de manière générale, ainsi que d'autres acides gras à chaîne courte, dans le tractus gastro-intestinal des humains et d'autres mammifères comme produit final de la digestion microbienne des glucides.
Proprietes physiques et chimiques
- L'acide propanoïque est un liquide incolore et grasse, avec un acre, une odeur désagréable et rance.
- Il a un poids moléculaire de 74,08 g / mol et une densité de 0,992 g / ml.
- Son point de congélation et d'ébullition est de -20,5 ° C et 141,1 ° C, respectivement.
- L'acide propanoïque est un acide faible, dont la PKA est 4,88.
- Le composé est très soluble dans l'eau, pouvant dissoudre 34,97 grammes composé de 100 ml de solvant. Il est également soluble dans l'éthanol, l'éther et le chloroforme.
Peut vous servir: composés organiques: caractéristiques, classification, exemples- Il possède des propriétés physiques intermédiaires entre celles des plus petits acides carboxyliques, des acides formiques et acétiques et des acides gras plus gros.
- Il montre les propriétés générales des acides carboxyliques et peut former des dérivés d'amide, d'ester, d'anhydride et de chlorure.
- Vous pouvez subir une alpha-halogénation avec Bromo en présence de PBR3 comme catalyseur (la réaction HVZ) pour former CH3CHBRCOOH.
Réactivité et dangers
L'acide propanoïque est un matériau inflammable et de carburant. Il peut être allumé par la chaleur, les étincelles ou les flammes. Les vapeurs peuvent former des mélanges explosifs avec l'air, pouvoir se rendre à la source d'allumage et d'exploiter.
La plupart des vapeurs sont plus lourdes que l'air. Ils seront étendus le long du sol et seront collectés dans des zones basses ou confinées (égouts, sous-sols, réservoirs). Danger ou égouts intérieurs, extérieurs ou égouts.
Les substances désignées avec un (p) peuvent être en polymère en explosion. Les conteneurs peuvent exploser lorsqu'ils sont chauffés.
Le composé doit être tenu à l'écart de la chaleur ou des sources d'allumage. Lorsqu'il est chauffé à la décomposition émet une fumée acre et des fumées irritantes.
L'acide propanoïque est irritant pour la peau, les yeux, le nez et la gorge, mais ne produit pas d'effets systémiques aigus et n'a pas de potentiel génotoxique démontrable. En cas de contact, vous devez vous laver avec beaucoup d'eau.
Biochimie
La base conjuguée de l'acide propanique, le propionate, est formée comme le fragment terminal à trois carbone (activé avec de la coenzyme tel que le propionyl-CoA) dans l'oxydation des acides gras du nombre impar et l'oxydation de la chaîne latérale de latérale chaîne de la chaîne latérale du cholestérol.
Peut vous servir: constante d'ionisationDes expériences avec des isotopes radioactifs de propionate injectés à des rats à jeun indiquent qu'il peut apparaître dans le glycogène, le glucose, les intermédiaires du cycle d'acide citrique, les acides aminés et les protéines.
La route du métabolisme de l'acide propanoïque implique l'interaction avec la coenzyme A, la carboxylation pour former du méthylmalononyl-coenzyme A et la conversion en acide succinique, qui entre dans le cycle d'acide citrique.
L'acide propanoïque peut s'oxyder sans former des corps de cétone et, contrairement à l'acide acétique, est incorporé dans un glucides, ainsi qu'un lipide.
Propionic acide est l'un des acidités organiques les plus fréquents, une maladie qui comprend de nombreux troubles divers.
Le résultat de patients nés avec un acide propionique est médiocre dans les modèles de développement intellectuel, avec 60% qui ont un coefficient intellectuel inférieur à 75 et qui nécessitent une éducation spéciale.
Le foie et / ou les greffes rénales réussies chez quelques patients ont entraîné une meilleure qualité de vie, mais n'ont pas nécessairement empêché les complications neurologiques et viscères.
Ces résultats soulignent la nécessité d'une surveillance métabolique permanente, quelle que soit la stratégie thérapeutique.
Applications
- L'acide propanoïque inhibe la croissance bactérienne et les moisissures à des niveaux entre 0,1 et 1% en poids. En conséquence, la plupart de l'acide propane produit est consommé comme conservateur pour les aliments et les aliments de consommation humaine, tels que les céréales et les céréales.
- Environ 51% de la consommation mondiale d'acide propanoïque est destinée à l'alimentation animale et à la préservation des céréales, tandis que près de 29% sont utilisés dans la production de propionatos de calcium et de sodium, qui sont également utilisés dans l'industrie alimentaire et alimentaire.
Peut vous servir: Hydrure de lithium: structure, propriétés, obtention, utilisations- D'autres marchés importants pour l'acide propane sont la production d'herbicide et celle de Cetona diéthyl. Les applications à volume inférieur comprennent le propionate de cellulose en acétate, les produits pharmaceutiques, les solvants, l'aromatisation et le parfum, la plastification, les colorants et les textiles, les assistants en cuir et en caoutchouc.
- La demande d'acide propanoïque dépend en grande partie de la production d'aliments et de céréales, suivis des aliments emballés et des produits de boulangerie.
- D'autres marchés à croissance rapide incluent des esters de propionate pour les solvants, tels que le n-Butilo et le propionate de pentilo. Ces esters sont de plus en plus utilisés comme substituts des solvants répertoriés comme polluants atmosphériques dangereux.
Les références
- L'acide propionique. Récupéré d'EBI.CA.ROYAUME-UNI.
- L'acide propionique. HMDB a récupéré.CA.
- Manuel de l'économie chimique acide propionique. Récupéré de IHS IHS.com.

