Structure de l'acide perracétique, propriétés, objets, utilisations
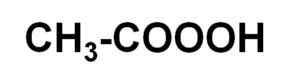
- 866
- 60
- Anaïs Julien
Il l'acide peracétique C'est un composé organique liquide dont la formule chimique est C2H4SOIT3. C'est du peroxyde d'acide acétique, il est donc également connu sous le nom d'acide perxyacétique. Sa molécule est similaire à celle de l'acide acétique ch3COOH mais avec un oxygène supplémentaire en carboxyle.
Il appartient à la classe de peroxydes organiques, qui sont des molécules de l'homme. Les propriétés germicide et stériliantes de leurs solutions aqueuses sont connues depuis 1902. Cette action peut dans certains cas l'exercer à des concentrations aussi faibles que 0,001%.
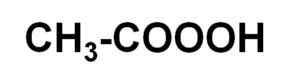 L'acide peracétique. Auteur: Marilú Stea.
L'acide peracétique. Auteur: Marilú Stea. Cette propriété le rend largement utilisé dans les cliniques et les hôpitaux pour stériliser les équipements médicaux, avec l'avantage supplémentaire que leurs produits de décomposition ne sont pas toxiques pour l'être humain.
Les solutions PAA sont fortement oxydantes, une caractéristique qui a été utilisée pour blanchir la pulpe de papier ou les blanchisseries. Elle s'applique également à l'exécution des réactions chimiques dans lesquelles cette propriété est requise, comme l'époxydation et l'hydroxylation.
Son action oxydante et désinfectante a utilisé dans le nettoyage de l'équipement où les aliments et les boissons sont transformés. De plus, il est corrosif pour certains métaux et lorsqu'il est stocké doit être tenu à l'écart des composés organiques ou facilement oxydables.
Référez-vous que vos solutions concentrées peuvent être explosives, c'est pourquoi elle doit de préférence préparer et stocker dans des endroits froids. Sa force corrosive s'applique également à la peau, aux muqueuses et aux tissus de l'être humain, il doit donc être manipulé avec prudence et avec un équipement de protection.
[TOC]
Structure
L'acide perxyacétique a une molécule très similaire à celle de l'acide acétique mais avec un oxygène supplémentaire dans la structure du groupe -COOH, car il a 3 atomes d'oxygène au lieu de deux.
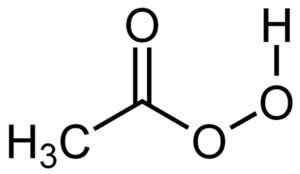 Structure d'acide peracétique. Auteur: su-no-g. Source: Selfmade. Source: Wikipedia Commons.
Structure d'acide peracétique. Auteur: su-no-g. Source: Selfmade. Source: Wikipedia Commons. Nomenclature
- L'acide peracétique
- Acide perxyacétique
- Acide Etanooperoxoïque
- PAA (acronyme anglais Acide peroxacétique).
Propriétés
État physique
Liquide sans moloïde transparent avec une forte odeur de vinaigre.
Poids moléculaire
76,05 g / mol
Point d'ébullition
110 ºC (avec explosion)
Point d'inflammation
40,5 ºC (méthode de la coupe ouverte)
Température d'auto-direction
200 ºC (c'est la température à spontanément)
Densité
1 226 g / cm3 à 15 ºC
Gelée
3 280 cp à 25,6 ºC
Indice de réfraction
1 3974 à 20 ºC
Solubilité
Il est miscible avec l'eau dans n'importe quelle proportion. Il est soluble dans les solvants organiques polaires, comme l'éthanol. Légèrement soluble dans les solvants aromatiques. Très soluble dans l'éther et l'acide sulfurique.
pH
Moins de 2.
Constante de dissociation
PAQUETpour = 8,20 à 25 ºC (il est plus faible que l'acide acétique de Pkpour = 4,8)
Propriétés chimiques
En tant qu'acide, la PAA est beaucoup plus faible que l'acide à partir de laquelle l'acide acétique vient.
Présente un potentiel élevé en tant qu'oxydant. Il est très réactif, il est donc difficile à stocker et cela a limité son utilisation.
Ses produits de dégradation sont acides acétiques ch3COOH, oxygène ou2, Peroxyde d'hydrogène h2SOIT2 et l'eau h2SOIT. Le H2SOIT2 se dégrade à son tour en eau et en oxygène. Tous ces composés sont en sécurité environnementale.
Il s'agit d'un agent époxydant et hydroaxilat pour les liaisons oléfiniques (doubles liaisons C = c). Cela signifie que participe activement à la formation d'époxydes dans des doubles liaisons de molécules organiques et dans l'ajout de groupes -OH dans ces.
Le PAA est corrosif vers certains métaux tels que l'acier lisse, le fer galvanisé, le cuivre, le laiton et le bronze. Les autres métaux sont résistants tels que l'acier inoxydable, l'aluminium pur et le fer tissé.
Peut vous servir: composé chimiqueAttaquez les gencives synthétiques et naturelles et extrait le plastifiant de certains polymères en vinyle.
Il a une odeur nette et acre qui rappelle celle de l'acide acétique (l'acide acétique est le composant principal du vinaigre).
Obtention
En réagissant à l'acide acétique glaciaire (anhydre, c'est-à-dire sans eau) avec du peroxyde d'hydrogène H2SOIT2 En présence d'un acide minéral (comme l'acide sulfurique H2Swin4), une partie des solutions oxydées et aqueuses d'acide acétique d'acide pertur2SOIT2.
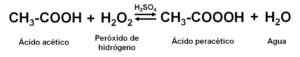 Obtenir des solutions aqueuses d'acide pertur. Auteur: Marilú Stea
Obtenir des solutions aqueuses d'acide pertur. Auteur: Marilú Stea Le H2Swin4 agit comme un catalyseur ou un accélérateur de réaction. Des agents stabilisateurs sont utilisés, comme l'acide pyridine-2,6-dicarboxylique.
Si ces solutions sont distillées, une concentration plus élevée de perture peut être obtenue.
Il peut également être obtenu par oxydation de l'acétaldéhyde ch3Cho avec de l'ozone ou3, ou par réaction de l'anhydride acétique (ch3CO)2Ou avec h2SOIT2.
Une autre façon de l'obtenir directement sur le site où elle est nécessaire est en ajoutant du tétra-acétyl-éthylendiamine (TaED) à une solution alcaline de H2SOIT2.
Applications
En médecine comme stérilisateur d'équipement
La PAA agit comme un désinfectant des équipements médicaux dans les cliniques, les hôpitaux, les cabinets médicaux et dentaires.
 Équipement dentaire stérilisé. Auteur: Daniel Frank. Source: Pexels.
Équipement dentaire stérilisé. Auteur: Daniel Frank. Source: Pexels. Certaines sources rapportent que leur action contre les micro-organismes peut être classée ainsi que: bactéries> virus> spores bactéries> kystes protozoaires. Cela signifie qu'il est plus efficace contre les bactéries et moins efficace contre les kystes protozoaires.
Dans des études réalisées sur l'action bactéricide de la PAA et d'autres désinfectants de haut niveau contre Staphylococcus aureus et Pseudomonas aeruginosa Dans l'équipement pour l'endoscopie, la PAA s'est avérée la plus rapide de son effet de microbicide.
Il Staphylococcus aureus Il peut produire des infections dans les tissus mous, dans la peau, la pneumonie et l'infection des tissus cardiaques. La Pseudomonas aeruginosa Il peut produire de la pneumonie.
Les bactéries forment des biofilms qui les protègent des stimuli externes ou du stress, à travers une épaisse couche de protéines extracellulaires, de polysaccharides et d'acides nucléiques.
Ces biofilms sont très résistants aux antibiotiques et désinfectants communs. Dans des équipes telles que les endoscopes, se forment généralement dans leurs canaux étroits, en raison de routines de nettoyage et de désinfection non adéquates ou non efficaces.
Le PAA attaque ces biofilms probablement par oxydation des liaisons moléculaires les plus sensibles de protéines, enzymes et autres métabolites. Cela conduit à la rupture des parois cellulaires des germes, de leurs spores et kystes.
De plus, lors de la pénétration de la cellule, la PAA peut oxyder les enzymes essentielles, nuisant au transport des molécules et des processus biochimiques vitaux.
Des temps de désinfection ont été établis depuis quelques années, mais au cours de certaines études, il a été observé que le traitement PAA a provoqué des changements dans la forme des cellules après seulement 5 minutes, avec une formation de sacs ou des renflements dans la paroi cellulaire des bactéries et l'effondrement de la cellule Structures de micro-organismes après 30 minutes.
Bien que le PAA se soit démarqué de leur vitesse, les chercheurs ont recommandé de réévaluer les temps établis dans les protocoles de nettoyage et de désinfection, ce qui les augmente pour la plupart des antiseptiques de niveau élevé, pour garantir l'efficacité totale de celles-ci.
L'un des aspects négatifs de la PAA est qu'il y a des agents pathogènes vers lesquels il n'est pas très efficace, comme les kystes du Giardia lamblia et de Cryptosporidium parvum (parasites qui peuvent produire de la diarrhée ou d'autres conditions intestinales).
Dans le traitement des eaux usées
L'effet désinfectant de la PAA sur les eaux usées municipales ou les industries est étudiée depuis plus de 30 ans.
Peut vous servir: hydrure de potassium: structure, formation, propriétés Usine de traitement de l'eau résiduelle. Auteur: Michal Jarmoluk. Source: Pixabay.
Usine de traitement de l'eau résiduelle. Auteur: Michal Jarmoluk. Source: Pixabay. Parmi ses avantages, il y a le large éventail de son activité germicide même en présence de matière organique, ainsi que le fait qu'aucun produit secondaire nocif n'est généré à l'environnement.
L'efficacité de son action semble dépendre entre autres facteurs de la quantité de matière organique présente dans l'effluent, du type et de la quantité de micro-organismes à éliminer, sur la concentration du PAA dans l'eau à traiter, le pH et le durée du traitement.
Dans certains cas, la PAA s'est avérée mieux que l'hypochlorite de sodium pour désinfecter les eaux usées dans les climats tropicaux et a été efficace contre le virus du choléra, parmi de nombreux autres agents pathogènes.
Cependant, l'un des points négatifs est qu'en raison de l'acide acétique restant après désinfection, l'effluent d'eau est chargé de matière organique, ce qui augmente le risque de nouvelle croissance des micro-organismes.
D'un autre côté, c'est un produit cher, il n'est donc pas encore très compétitif par exemple avec l'hypochlorite de sodium en raison de cet aspect.
Dans l'industrie alimentaire
Être un agent oxydant fort est très efficace contre les micro-organismes à basse température, ce qui a donné lieu à sa large utilisation en tant que bactéricide et fongicide dans la transformation des aliments et des boissons.
Cela comprend les plantes de transformation de viande et de poulet, les produits laitiers, les brasseries, les vignerons ou les vignobles et les boissons gazeuses. Dans tous ces endroits, la PAA demande à être idéal pour le nettoyage In situ (sur le site).
Les enzymes trouvées dans certains aliments tels que la peroxydase et la catalase, qui désactivent le peroxyde d'hydrogène H2SOIT2, Ils n'exercent pas d'effet nocif sur l'acide pertur. Les déchets de protéines ne lui font pas du mal non plus.
En raison du fait que dans les aliments, le PAA se décompose dans l'acide acétique et l'hydrogène, son utilisation est considérée comme sûre dans les applications dans lesquelles les aliments ne sont pas rincés.
Il sert de désinfectant et de stérilisation pour les réservoirs en acier inoxydable et en verre, les tuyaux et les camions-citernes, qui servent pour le transport et le stockage des boissons.
 Réservoirs en acier inoxydable pour stocker la bière. Auteur: Roberta Keiko Kitahara Santana. Source: Unsetpash.
Réservoirs en acier inoxydable pour stocker la bière. Auteur: Roberta Keiko Kitahara Santana. Source: Unsetpash. Sa caractéristique de la génération de produits non toxiques et que, en haute dilution, ne produisent pas de saveurs ou d'odeurs, constituent des économies de temps et d'argent pour ces industries.
Dans l'industrie des pâtes et papier
L'acide perracétique est un important agent sans chlore dans la technologie de blanchiment dans l'industrie de la production de pâte de papier.
Certains auteurs considèrent l'acide peracétique comme un dérivé activé de H2SOIT2, Où l'un des hydrogènes de cela a été remplacé par un groupe acilo ch3C (= o)-.
À la suite de cela, l'acide pertur2SOIT2 et qui peut être utilisé dans les réactions d'oxydation dans des conditions plus modérées qu'avec H2SOIT2.
Dans des conditions neutres ou modérément alcalines, le peracétate d'ions ch3C (= o) oo- pour être un nucléophile fort (il est attiré par les atomes déficients en électrons), remuer sélectivement les chromophores ou les composés colorés présents dans la pulpe papier.
Cela permet à ces industries d'avoir un blanchissement très efficace et dont les déchets ne polluent pas leurs effluents aqueux.
Peut vous servir: quel est l'erristeneo?Dans la production d'autres composés chimiques
L'acide perracétique sert d'oxydant pour préparer les composés époxy, comme catalyseur pour fabriquer des résines en polyester et obtenir du caprolactam et du glycérol.
Dans la récupération des polymères pour recycler
Certains chercheurs ont réussi à récupérer des matériaux utiles lors du traitement de certains déchets polymères avec des solutions PAA.
Le processus est effectué par l'oxydation de certains déchets de polymères renforcés avec de la fibre de carbone à partir d'activités aérospatiales, avec des solutions d'acide acétique glaciaire et du peroxyde d'hydrogène.
De cette façon, l'acide perture est généré In situ, qui décompose la résine époxy de 97% en laissant la fibre de carbone intacte.
Ensuite, par distillation, plus de 90% de l'acide acétique est récupéré, entraînant la décomposition supplémentaire du polymère qui génère des composés aliphatiques et phénoliques récupérables.
La fibre de carbone est obtenue propre et maintient sa longueur et sa résistance de traction comparables à celles des fibres vierges.
 Fibre de carbone. CJP24 [domaine public]. Source: Wikipedia Commons.
Fibre de carbone. CJP24 [domaine public]. Source: Wikipedia Commons. Le processus est effectué dans des conditions douces, sans émissions gazeuses, ce qui le rend respectueux de l'environnement.
En buanderie
En raison de sa puissance oxydante des composés colorés, l'acide peracétique est utilisé dans le blanchiment de la blanchisserie. Dans ces cas, le mélange de tétra-athyl-éthylendiamine avec h est utilisé2SOIT2 En milieu alcalin pour l'obtenir sur le site.
Son intervalle d'application est très large, car il peut être utilisé dans les eaux dures ou qui contiennent une proportion élevée de sels de calcium et de magnésium, à un pH comprise entre 3,0 et 7,5 et les températures de 0 à 40 ° C.
Des risques
L'acide perracétique ou le PAA peut être très corrosif. Il est fortement irritant pour la peau et les yeux.
Si leurs solutions sont ingérées, provoque la corrosion des muqueuses de la bouche, de la gorge, de l'œsophage et du tractus gastro-intestinal, provoquant des douleurs et des difficultés à avaler.
Si leurs vapeurs sont inhalées.
Les solutions contiennent. Ils peuvent se décomposer explosivement. Si la concentration de PAA en solution dépasse 56% peut déclencher en raison de l'évaporation violente de l'acide acétique.
La chaleur doit être évitée. Il est considéré comme un liquide inflammable. Sa décomposition est violente avec l'explosion à 110 ºC. Il doit être stocké dans des endroits frais, de préférence sous le refroidissement, ou dans des endroits très bien ventilés.
Il est fortement oxydant, donc dangereux en contact avec les matières organiques. Lorsqu'il est stocké, il doit être isolé des autres composés, en particulier des composés organiques, inflammables ou oxydables. Il doit être séparé des acides, des alcalis et des métaux lourds.
Lorsqu'il est chauffé à la décomposition émet des acres et des vapeurs irritantes, qui irritent les yeux, le nez et la gorge.
S'il est renversé, il ne devrait pas être autorisé à couler vers les drains car dans ces éléments, un danger de feu ou d'explosion est créé.
En tant que mesures préventives pour la manipulation, les gants en caoutchouc et les vêtements de protection, le bouclier facial ou la protection des yeux (verres ou verres de sécurité), la protection respiratoire et ne pas manger, boire ou fumer pendant le travail avec leurs solutions sont recommandées.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). L'acide peracétique. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Das, m. et al. (2018). Une méthode efficace de réyclé. ACS Chimie et ingénierie durable. Récupéré des pubs.ACS.org.
- Chinois, t. et al. (2017). Les effets morphologiques bactéricide à action rapide de l'acide peracétique, un désinfectant de haut niveau, contre Staphylococcus aureus et Pseudomcas aéugineux Biofilms en tube. Antimicrobs résiste au contrôle de l'infection. 2017: 6: 122. NCBI a récupéré.NLM.NIH.Gouvernement.
- Pain, g.X. et al. (1999). Réactivité de l'acide férulique et de son dérive vers la pose d'hydrogène et l'acide peracique. J. Agrique. Chem alimentaire. 1999, 47, 3325-3331. Récupéré des pubs.ACS.org.
- Kitis, Mehmet. (2004). Dissifection des eaux usées avec de l'acide peracétique: une revue. Environnement International 30 (2004) 47-55. Récupéré de ScienceDirect.com.
- « Structure d'acide phénylacétique, propriétés, utilisations, effets
- Caractéristiques de réflexion verticale, méthode et exemples »

