Acide faible
- 2285
- 73
- Adrien Remy
 Exemples d'acide faible
Exemples d'acide faible Qu'est-ce qu'un acide faible?
Un acide faible est celui qui en solution aqueuse a peu de capacité à se dissocier dans l'hydrogène (H+) et dans sa base conjuguée correspondante. Contrairement aux acides forts, dont la dissociation est complète (100%) et pratiquement irréversible, les acides faibles sont à peine dissociés et réversibles.
Par conséquent, un acide faible génère moins de tonnes h+ Dans l'eau de ce qui serait attendu. Parmi les acides faibles les plus représentatifs, nous avons de l'acide acétique, la composante principale du vinaigre, qui est approximativement dans un 0.5% dans des conditions normales.
Cela signifie que la plus grande proportion d'une solution d'acide acétique dans l'eau, comme 5% de vinaigre de cuisson, est sous forme non dissociée (ch3COOH); Tandis qu'une petite portion se trouve comme la base conjuguée (choisissez3Roucouler-), accompagné de hions h+, ou plus correctement, les ions h3SOIT+.
Ensuite, comme la quantité d'hydrogène libérée par un acide faible en solution aqueuse est faible, le pH qu'ils produisent est plus élevé (de base) que celui produit par un acide fort. Par exemple, le vinaigre a un pH de 2.5, jus d'orange pH 3.3. 4.2 et le 2 jus de citron de 2.
Ces pH, bien qu'ils soient acides, sont plus élevés que le pH qui produisent une solution d'un acide fort (HCl, H2Swin4, etc.) qu'ils peuvent atteindre la valeur de 1 ou moins (valeurs de pH négatives).
Caractéristiques des acides faibles
pH de vos solutions
Les acides faibles ont généralement un pH entre 2.0 et moins de 7.0, donc ils tournent la couleur du papier pannasol en rouge. Ces valeurs de pH sont nombreuses plus élevées que les valeurs de pH produites par des acides forts, bien qu'il existe des exceptions.
Par exemple, une solution d'acide chlorhydrique de 1 mm (un acide fort), a un pH de 3.0, tandis qu'une solution de 1 mm d'acide fluorhorique (un acide "faible"), a un pH de 3.2, qui est proche de celui de l'acide fort.
Ionisation partielle
Les acides faibles en solution sont ionisés peu ou partiellement dans l'eau, se dissociant dans la base conjuguée de l'acide et de l'ion hydrogène. Ensuite, un acide faible en solution aqueuse est principalement dissocié, avec une petite proportion dissociée.
Peut vous servir: équilibre des équations chimiquesLorsque la quantité d'hydrogène libérée par un acide faible dans l'eau est faible, le pH produit par cet acide est plus élevé que celui produit par un acide fort dissous dans l'eau, car ceux-ci sont généralement ionisés de 100%.
Ionisation réversible
L'ionisation d'un acide faible est généralement schématique comme suit:
A ⇌ a- + H3SOIT-
Où y a-t-il de l'acide faible, pour- sa base conjuguée, et h3SOIT+ le cation hydronium, qui est le chemin en h+ Il existe ou se manifeste dans l'eau. La concentration (ou l'activité) de H3SOIT+ Il est utilisé à la place de H+ Pour la détermination de la solution de la solution.
Diplôme d'ionisation
Certains acides sont plus faibles que d'autres, ce qui est le même à dire qu'ils sont moins ionisés. Par conséquent, le degré d'ionisation nous permet d'apercevoir à quel point un acide est acide dans certaines conditions.
Pour exprimer le degré d'ionisation, plusieurs paramètres ont été introduits, tels que la constante d'ionisation ou d'acidité (KA) et la PKA: une façon d'exprimer KA dans un nombre simple qui omet l'utilisation d'un nombre exprimé en puissances négatives de dix (10 ), comme il existe dans le ka.
Les constantes KA et PKA sont principalement utilisées pour les acides faibles.
Ka = [a-] [H+] / [Ha]
Les supports présents dans la formule représentent des concentrations.
pka = - log ka
La valeur PKA d'un acide faible se situe généralement entre 2 et 12. Mais il y a des exceptions. Par exemple: et et l'acide odagique (Hio3) a une PKA de 0.77, qui est considéré comme une valeur relativement petite, mais sans être négatif, pour un acide faible dans un sens strict.
Stabilité de base conjuguée
Les acides faibles ont une forte liaison avec l'atome d'hydrogène acide (Hδ+-Xδ-), ils ont donc un faible degré de dissociation de l'hydrogène. Il en résulte la base conjuguée de l'acide faible a une grande avidité par l'hydrogène, étant une base conjuguée forte.
Peut vous servir: colloïdeC'est-à-dire que la base conjuguée d'un acide faible est très instable, car elle accepte h+ retourné très facilement. Plus cette base conjuguée est instable, plus l'acide sera faible en question.
Faible conductivité ionique
Étant peu ionisés, les acides faibles sont de mauvais conducteurs d'électricité, contrairement aux acides forts qui sont de bons conducteurs d'électricité.
Présence dans la nature
Les acides faibles sont largement répartis de nature, par exemple, ils sont en agrumes (citron, pamplemousse, orange, etc.).
Ils sont également présents dans de nombreux processus qui se produisent dans tous les êtres vivants. Certains de ces acides biologiques faibles sont pyruviques, lactiques, citriques, fumariques, succiniques, glutamiques, etc., Et même l'hémoglobine oxygénée libère des hydrogénions, donc il se comporte comme un acide faible.
Ensuite, on peut conclure que l'homme vit en contact permanent avec des acides faibles.
Comment calculer le pH d'un acide faible?
Le pH d'un acide faible peut être calculé en utilisant la constante d'acidification (KA) ou en utilisant l'équation de Henderson-Haselbalch. Dans le premier exemple, KA sera utilisé.
Avec une constante d'acidité
Calculez le pH d'une solution 0.5 m d'acide benzoïque (c6H5COOH), qui a une constante d'ionisation (ka) = 1.8 x 10-5
C6H5COOH ⇌ C6H5Roucouler- + H+ (1)
Si la quantité d'acide qui se dissocie est appelée x, alors 0.5 M-X sera la concentration d'acide faible non dissocié en équilibre, étant x la concentration de la base conjuguée de l'acide benzoïque et de la concentration en ions hydrogène.
L'équation (1) peut être représentée comme suit:
0.5 m-x ⇌ x + x
Les acides faibles sont ionisés dans une proportion très faible, donc la concentration d'acide benzoïque dans l'équilibre de (0.5 m-x), peut être supposé 0.5 m, depuis x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Par conséquent, [H+] est égal à 3 x 10-3 M. Nous résolvons ensuite en calculant le pH:
Il peut vous servir: méthode MOHR: fondamentaux, réactions, procédure, utilisationspH = - log [h+]]
= - log [3 x 10-3]]
pH = 2.52
Notez que le pH est relativement acide, car il est situé en dessous de 3 ou 4.
Avec l'équation de Henderson-Haselbalch
L'équation de Henderson-Haselbalch est utilisée pour calculer le pH d'une solution tampon:
pH = pKa + log [base conjuguée] / [acide]
Exemple:
L'hydroxyde de sodium (NaOH) est ajouté à une solution d'acide acétique, produisant une concentration finale d'acide acétique (ch3COOH) 1.11 x 10-2 mol / L et une concentration de base conjuguée (choisissez3Roucouler-) de 0.44 x 10-2 mol / L. Si l'acide acétique PKA est 4.75 Calculez le pH de la solution.
pH = 4.75 + log [A-] / [Ha]
pH = 4.75 + log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ journal 0.396
= 4.348
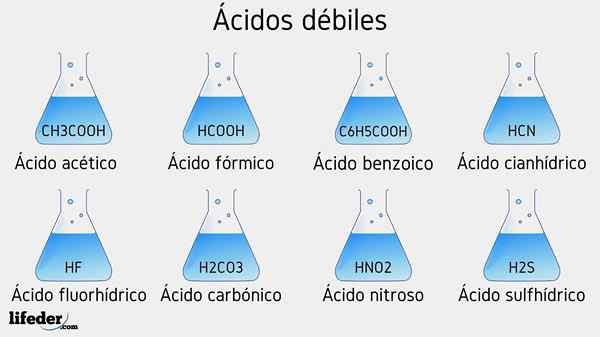
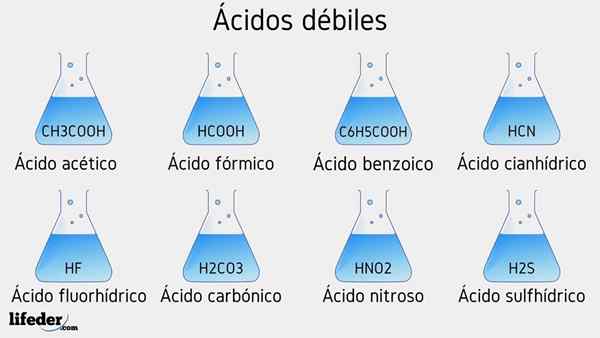
Exemples d'acide faible
Plusieurs acides faibles accompagnés de leurs valeurs de PKA seront répertoriés ci-dessous:
- Ch3COOH (acide acétique), PKA 4.75
- HCOOH (acide formique), PKA 3.74
- C6H5COOH (acide benzoïque), PKA 5.59
- Ch2Clcooh (acide chloroacétique), PKA 2.85
- HCN (acide cyanhydrique), PKA 9.31
- HF.17
- C2H5COOH (acide propionique), PKA 4.89
- HNO2 (Acide nitreux), PKA 3.35
- H2S (acide sulfure), PKA1 6.0 et PKA2 12.92
- CCL3COOH (acide trichloroacétique), PKA 0.52
- H2CO3 (acide carbonique), PKA1 6.37 et PKA2 dix.22
- H3Pote4 (acide phosphorique), PKA1 2.12, PKA2 4.21 et PKA3 onze.0
- C6H5Swin3H (acide benzefonique), PKA 0.70
- Hio3 (Yodium Acid), PKA 0.77
- Hclo2 (Chloro Acid), PKA 2.0
- Ch3Ch2(OH) COOH (acide lactique), PKA 3.08
Acides faibles avec des utilisations thérapeutiques
- Acide salicylique, PKA 3.00
- Acide acétylsalicylique, PKA 3.49
- Furosémide, PKA 3.90
- Ibuprofène, pka 4.40
- Levodopa, PKA 2.30
- Phénobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Morris, J. g. (1974). Physicochimie pour les biologistes. (2e éd.). J'ai inversé.
- Helmestine, Anne Marie, Ph.D. (29 août 2020). Faible définition et exemple d'acide en chimie. Récupéré de: Thoughtco.com
- Ophardt c., & McCarthy L. (15 août 2020). Acidre et résistance à la base. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Clark Jim. (2013). Acide fort et faible. Récupéré de: Chemguide.co.ROYAUME-UNI
- Apprentissage de la lumière. (s.F.). Chimie pour les non-majors: calcul du pH des solutions de faible acide et de base. Récupéré de: cours.Lumenarning.com

