Structure du bromure de potassium (KBR), propriétés, utilisations
- 840
- 35
- Mlle Ambre Dumont
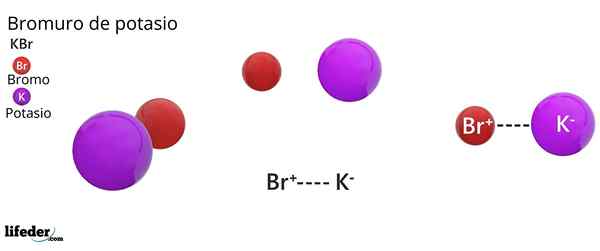
Il bromure de potassium C'est un sel inorganique dont la formule chimique est kbr. Il est formé par l'union électrostatique d'un anion de bromure, Br-, Et un cation potassium, k+, dans une proportion 1: 1; c'est-à-dire que nous avons la même quantité de br- Depuis k+ Dans les cristaux KBR.
Le bromure de potassium est un sel blanc massif ou cristallin, il est inodore, très soluble dans l'eau et peu soluble dans l'éthanol et l'éthanol. Il a été utilisé lors de la dernière partie du XIXe siècle et une grande partie du XXe siècle dans le traitement de l'épilepsie et comme sédatif.
Jusqu'en 1975, il a continué à se vendre librement, l'année où son utilisation a diminué en raison des effets toxiques qu'il a produits sur les patients. Actuellement, il est toujours utilisé dans plusieurs espèces d'animaux dans le traitement des crises, bien qu'à partir de 1912, il a été remplacé par un phénobarbital de sodium.
Le bromure de potassium est utilisé dans des études optiques correspondant à la région infrarouge voisine du spectre électromagnétique. Il sert également de matériel utilisé dans le domaine de la photographie.
[TOC]
Type de liaison
Le bromure de potassium est un sel binaire, le produit de la combinaison d'un atome de brome avec un état d'oxydation -1, avec un atome de potassium avec un état d'oxydation +1. Par conséquent, une attraction électrique entre l'ion BR est établie- Et le k ion+.
Ce type d'interaction électrique ou électrostatique est connu sous le nom de liaison ionique, qui se dissocie lorsque le sel de bromure de potassium se dissout dans l'eau, libérant les k ions+ et br-.
Ces ions sont désintégrés par les propriétaires d'eau.
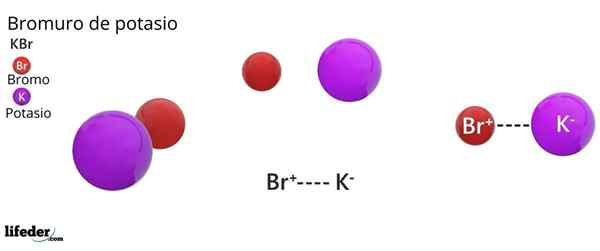
Structure de bromure de potassium
 Structure cristalline FCC du KBR: Les sphères brunes correspondent au Br-, tandis que les sphères violet correspondent aux cations k+
Structure cristalline FCC du KBR: Les sphères brunes correspondent au Br-, tandis que les sphères violet correspondent aux cations k+ Le bromure de potassium présente une structure cristalline cubique centrée sur le visage (FCC) Cubique centré sur le visage), égal à celui observé dans le chlorure de sodium.
Peut vous servir: Faraday constanteDans cette structure, chaque anion br- Il est lié ou coordonné avec six k cations+, Et à son tour, chaque k+ Il a six BR- En tant que voisins dans les réseaux cristallins.
Nomenclature
Le bromure de potassium est classé comme un halogénure ou un halogogénide de métal alcalin. Les noms de ces sels sont construits en éliminant la dernière lettre du nom de l'halogène (chlore, brome, iode, fluor et astato), à l'exception du fluorure, et en remplaçant la lettre finale par le suffixe -uro. Le nom du métal est écrit ci-dessous sans modification.
Par exemple: chlorure de sodium, iodure de potassium, fluorure de calcium, etc. C'est pourquoi le KBR est appelé bromure de potassium ou bromure de potassium (selon la nomenclature traditionnelle).
Propriétés du bromure de potassium
 Disque d'horloge avec granules kbr. Source: Walkerma via Wikipedia.
Disque d'horloge avec granules kbr. Source: Walkerma via Wikipedia. Aspect physique
Verre incolore, granules cristallins ou blancs.
Odeur
Toilettes
Saveur
À une concentration élevée, il a un goût amer et épicé.
Masse molaire
119.02 g / mol
Densité
2.74 g / cm3 à 25 ºC
Point de fusion
734 ºC
Point d'ébullition
1435 ºC
Solubilité dans l'eau
535 g / L A 0 ºC
678 g / L A 25 ºC
1020 g / L A 100 ºC
1 gramme de sel est dissous dans 1 ml d'eau bouillante, ce qui indique qu'il est très soluble dans l'eau.
Solubilité dans le glycérol
217 g / L
1 gramme de bromure de potassium se dissout dans 4.6 ml de glycérol.
Solubilité en éthanol
47.6 g / L A 80 ºC.
1 gramme de bromure de potassium se dissout dans 250 ml d'éthanol.
Densité de vapeur
7.14 Dans la relation aérienne prise comme l'unité.
La stabilité
Stable s'il est stocké dans les conditions recommandées. Incompatible avec les agents oxydants, les acides forts, le trifluoride de brome et le brome.
Décomposition
Lorsqu'il est chauffé à la décomposition émet des produits nocifs, comme le bromure d'hydrogène et l'oxyde de potassium.
Peut vous servir: Configuration électronique du noyau: construction, exemplesIndice de réfraction (ND)
1.559
pH
En solution aqueuse produit un pH neutre, environ 7.
point d'allumage
1435 ºC
Dissolution et réactivité
En solution aqueuse, le KBR est complètement dissocié pour provoquer une solution de pH neutre.
Le sel est une source de bromure qui peut être utilisé pour la production de bromure d'argent, AGBR, composé utilisé dans le développement de photographies:
Kbr (ac) + agno3 (AC) → AGBR (S) + KNO3 (AC)
De plus, le KBR est un agent réducteur faible, incompatible avec le mercure et les sels d'argent. Produit une réaction violente avec le trifluorure de brome. Peut réagir avec de nombreux sels, alcaloïdes et amidon.
Il réagit également avec les acides, par exemple, avec de l'acide sulfurique concentré, libérant du bromure d'hydrogène.
Applications
Traitement d'épilepsie et de crises
Les propriétés anticonvulsives du bromure de potassium ont d'abord été exposées par Sir Charles Locock, lors d'une réunion de la Royal Medicine and Chirurgical Society en 1857, qui a favorisé son utilisation dans le traitement de l'épilepsie.
Le bromure de potassium a été utilisé comme médicament prioritaire dans le traitement de l'épilepsie et comme sédatif jusqu'en 1912, lorsque le phénobarbital de sodium a été annoncé.
Malgré cela, il a été continué à être utilisé comme complément au phénobarbital de sodium dans le traitement des crises d'épilepsie.
En 1975, en raison de son caractère toxique, la FDA U.S. (Food & Drug Administration) a décidé de ne pas recommander l'utilisation de bromure de potassium, à la fois chez l'homme et les animaux. Cependant, certains pays ont continué à l'administrer.
Le bromure de potassium a été utilisé comme hypnotique et sédatif chez les bovins, les chevaux, les moutons et les porcs. Il a également été utilisé dans le traitement des coliques et de la tétania chez les chevaux et dans le traitement des crises chez les chiens.
Optique infrarouge
En raison de la transparence du bromure de potassium dans une gamme de longueurs d'onde entre la lumière ultraviolette et l'infrarouge proche, il est utilisé comme composant des fenêtres pour plusieurs rayonnements électromagnétiques, en particulier le rayonnement infrarouge.
Peut vous servir: osmolaritéPlusieurs techniques sont utilisées à cet égard. L'un d'eux consiste à élaborer deux disques cristallins de bromure de potassium, plaçant un film du matériel à analyser dans l'infrarouge dans les albums. Les études sont menées dans l'infrarouge proche entre 780 nm et 3000 nm.
La photographie
 Le KBR faisait partie des matériaux utilisés pour traiter les premières photographies du XXe siècle
Le KBR faisait partie des matériaux utilisés pour traiter les premières photographies du XXe siècle Le bromure de potassium a eu de nombreuses utilisations et applications en photographie, par exemple: il a été utilisé pour formuler des développeurs de photographie, dans la fabrication de films photographiques, en tant que film épaisse et en couleur de couleurs de couleur.
Il est utilisé dans l'amélioration de la différenciation entre les halogénures d'argent cristaux exposés et non exposés, dans l'augmentation de la densité d'impression des négatifs minces, et en tant qu'halogogénide secondaire, en combinaison avec des iodures, pour le traitement du papier négatif sur papier.
Il a également été utilisé en combinaison avec le bichlorure de mercure, le sulfate de cuivre ou le ferricianurio de potassium dans les gradins photographiques. Il a également servi de limiteur chez les développeurs alcalins utilisés pour les plaques de gélatine et les documents de développement.
Analyse chimique
Le KBR est utilisé pour déterminer l'évaluation du cuivre et de l'argent, dans l'analyse polarographique de l'Inde, du cadmium et de l'arsenic.
Autres utilisations
Il est utilisé dans les processus de gravure de lithographie, dans le traitement de l'huile, dans la stabilisation thermique du nylon, dans la fabrication de fibres, et enfin dans la fabrication de savons spéciaux.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Jour, r., & Underwood, un. (1986). Chimie analytique quantitative (Fifth Ed.). Pearson Prentice Hall.
- Wikipédia. (2020). Bromure de potassium. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2021). Bromure de potassium. PubChem Comunund Résumé pour CID 253877. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Emea. (1999). Bromide, sel de potassium: rapport de résumé. [PDF]. Récupéré de: EMA.L'Europe .UE
- Sevier B.V. (2020). Bromure de potassium. ScienceDirect. Récupéré de: ScienceDirect.com

