Structure d'acide chromique, propriétés, obtention, utilisations

- 2900
- 924
- Jade Duval
Il acide chromique ou h2Cro4 L'acide associé à l'oxyde de chrome (VI) ou à l'oxyde crro3. Cette dénomination est due au fait que dans les solutions aqueuses acides de l'oxyde chromique, l'espèce H2Cro4 Il est présent avec d'autres espèces de chrome (VI).
Oxyde cromique3 Il est également appelé acide chromique anhydre. Le CRO3 C'est un solide rougeâtre ou brun violet qui est obtenu lors du traitement des solutions de dichromate de potassium k2Croisement2SOIT7 Avec de l'acide sulfurique H2Swin4.
 Écrase3 Dans un melting pot. Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons.
Écrase3 Dans un melting pot. Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons. Les solutions aqueuses de l'oxyde chromique connaissent un équilibre de certaines espèces chimiques dont la concentration dépend du pH de la solution. Le pH de base prédominait les ions de cromate CRO42-, Tandis que les ions acides HCRO prédominent4- et cr dicromato2SOIT72-. On estime que l'acide acide est également présent de l'acide chromique H2Cro4.
En raison de sa grande puissance oxydante, des solutions d'acide chromique sont utilisées en chimie organique pour effectuer des réactions d'oxydation. Ils sont également utilisés dans les processus électrochimiques pour traiter les métaux afin qu'ils acquièrent une résistance à la corrosion et à l'usure.
Certains matériaux polymères sont également traités avec de l'acide chromique pour améliorer leur adhérence aux métaux, aux peintures et autres substances.
Les solutions d'acide chromique sont très dangereuses pour les humains et la plupart des animaux et l'environnement. Pour cette raison, les déchets liquides ou solides où l'acide chromique est utilisé est traité pour éliminer le chrome (VI) ou pour récupérer tous les chromes et régénérer l'acide chromique pour le réutiliser.
[TOC]
Structure
La molécule d'acide chromique H2Cro4 Il est formé par un cromato cro ion42- et deux ions hydrogène h+ Unis à cela. Dans l'ion chromate, l'élément de chrome est dans un état d'oxydation de +6.
La structure spatiale de l'ion chromate est tétraédrique, où le chrome se trouve au centre et l'oxygène occupe les quatre sommets du tétraèdre.
Dans l'acide chromique Les atomes d'hydrogène sont chacun à côté d'un oxygène. Des quatre liaisons de chrome avec les atomes d'oxygène, deux sont doubles et deux sont simples, car ils ont les hydrogènes unis à eux.
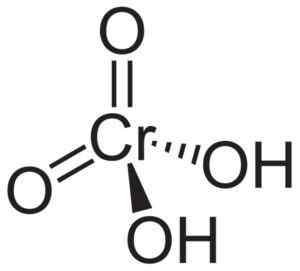 Structure d'acide chromique H2Cro4 où la forme tétraédrique de chromate et ses doubles liaisons sont observées. Neuroteker [domaine public]. Source: Wikipedia Commons.
Structure d'acide chromique H2Cro4 où la forme tétraédrique de chromate et ses doubles liaisons sont observées. Neuroteker [domaine public]. Source: Wikipedia Commons. D'un autre côté, CRO -Croomic Oxyde3 Il a un atome de chrome d'oxydation +6 entouré de seulement trois atomes d'oxygène.
Nomenclature
- Acide cromique h2Cro4
- Acide tétraoxochromique H2Cro4
- Oxyde cromique (acide chromique anhydre) CRO3
- Trioxyde de chrome (acide chromique anhydre) CRO3
Propriétés
État physique
Anhydro ou oxyde chromique L'acide chromique est un solide cristallin de violet à rouge
Poids moléculaire
Cro3: 118.01 g / mol
Point de fusion
Cro3: 196 ºC
Au-dessus de son point de fusion est thermiquement instable, il perd de l'oxygène (il est réduit) pour donner de l'oxyde de chrome (III) CR2SOIT3. Il se décompose à environ 250 ºC.
Densité
Cro3: 1,67-2,82 g / cm3
Solubilité
Le CRO3 Il est très soluble dans l'eau: 169 g / 100 g d'eau à 25 ºC.
Il est soluble dans les acides minéraux tels que sulfurique et nitrique. Alcool soluble.
Autres propriétés
Le CRO3 C'est très hygroscopique, ses cristaux sont délicieux.
Quand le CRO3 Il se dissout dans l'eau forme des solutions fortement acides.
Peut vous servir: titane: histoire, structure, propriétés, réactions, utilisationsC'est un oxydant très puissant. Oxy Matter vigoureusement organique sous presque toutes ses formes. Attaque le tissu, le cuir et certains plastiques. La plupart des métaux attaquent également.
Il est fortement toxique et très irritant en raison de son potentiel oxydant élevé.
Chimie des solutions aqueuses où l'acide chromique est présent
Oxyde cromique3 Il se dissout rapidement dans l'eau. En solution aqueuse, le chrome (vi) peut exister sous différentes formes ioniques.
Un pH> 6,5 ou en solution alcaline chrome (vi) acquiert la forme de cromato42- jaune.
Si le pH est diminué (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , qui peut dimériser à ion dicromato cr2SOIT72-, Et la solution devient orange. À pH entre 2,5 et 5,5, les espèces prédominantes sont HCRO4- et cr2SOIT72-.
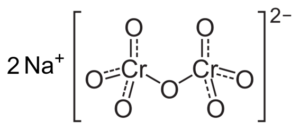 Structure d'ions Cr dicromate2SOIT72- qui est à côté de deux ions de sodium+. Capacio [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons.
Structure d'ions Cr dicromate2SOIT72- qui est à côté de deux ions de sodium+. Capacio [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons. Les soldes qui se produisent dans ces solutions lorsque le pH baisse sont les suivants:
Cro42- (chromate ion) + h+ ⇔ HCRO4-
HCRO4- + H+ ⇔ H2Cro4 (acide chromique)
2hcro4- ⇔ CR2SOIT72- (Dicromate ion) + h2SOIT
Ces soldes ne se produisent que si l'acide qui est ajouté pour abaisser le pH est3 ou hclo4, Parce qu'avec d'autres acides, différents composés sont formés.
Les solutions acides du dichromate sont des agents oxydants très énergiques. Mais dans les solutions alcalines, l'ion chromate est beaucoup moins oxydant.
Obtention
Selon les sources consultées, l'une des façons d'obtenir l'oxyde CRO Cromic3, Il s'agit d'ajouter de l'acide sulfurique à une solution aqueuse de dichromate de sodium ou de potassium, formant un précipité orange rouge.
 Oxyde cromique hydraté ou acide chromique. Himstakan [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons.
Oxyde cromique hydraté ou acide chromique. Himstakan [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons. Acide cromique h2Cro4 Il se trouve dans les solutions aqueuses d'oxyde chromique dans un milieu acide.
Utilisation de l'acide chromique
Dans l'oxydation des composés chimiques
En raison de sa capacité fortement oxydante, l'acide chromique est utilisé depuis longtemps et avec succès pour oxyder les composés organiques et inorganiques.
Parmi les innombrables exemples se trouvent les éléments suivants: il permet d'oxyder les alcools primaires aux aldéhydos et ceux-ci aux acides carboxyliques, aux alcools secondaires aux cétones, au toluène à l'acide benzoïque, à l'éthylbenzène à l'acétophénone, à l'acide forme2, acide oxalique en co2, acide lactique à l'acétaldéhyde et au CO2, Foi ferreux2+ Une foi ferrique3+, ion iodure en iode, etc.
Permet la conversion de nitrous compréhensive aux composés nitro, les sulfures en sulfones. Il intervient dans la synthèse des cétones à base d'alcènes, comme oxydait les alcènes hydroborés en cétones.
Composés très résistants aux oxydants habituels, tels que l'oxygène ou2 ou peroxyde d'hydrogène H2SOIT2, Ils sont oxydés par l'acide chromique. C'est le cas de certaines basses hétérocycliques.
Dans les processus d'anodisation métallique
L'anodisation de l'acide chromique est un traitement électrochimique qui s'applique à l'aluminium pour le protéger pendant de nombreuses années contre l'oxydation, la corrosion et l'usure.
Le processus d'anodisation implique la formation électrochimique d'une couche d'oxyde d'aluminium ou d'alumine sur le métal. Cette couche est ensuite scellée dans de l'eau chaude, qui est réalisée par conversion en oxyde d'aluminium trihydraté.
La couche d'oxyde scellée est épaisse, mais elle est structurellement faible et pas très satisfaisante pour les syndicats adhésifs ultérieurs. Cependant, en ajoutant une petite quantité d'acide chromique pour sceller l'eau, une surface est développée qui peut former de bonnes liaisons.
Peut vous servir: loi sur la conservation de la matièreL'acide chromique dans la scellage de l'eau se dissout une partie de la structure des cellules de type épaisse et laisse une mince, forte, fermement attachée à l'oxyde d'aluminium, à laquelle les adhésifs collent et forment des articulations fortes et durables.
L'anodisation avec de l'acide chromique s'applique également au titane et à ses alliages.
Dans les traitements de conversion chimique
L'acide chromique est utilisé dans les processus de revêtement de métal par conversion chimique.
Au cours de ce processus, les métaux sont immergés dans des solutions d'acide chromique. Cela réagit et dissout en partie la surface déposant en même temps une fine couche de composés de chrome complexe qui interagissent avec le métal de base.
Ce processus est appelé revêtement de conversion de chromat ou chrome de conversion.
Les métaux qui sont généralement soumis à un chrome de conversion sont différents types d'acier, tels que l'acier au carbone, l'acier inoxydable et l'acier à zinc, et plusieurs métaux non ferreux, tels que les alliages de magnésium, les alliages d'étain, les alliages d'aluminium, le cuivre, le cadmium, manganèse et argent.
Ce traitement fournit une résistance à la corrosion et à la luminosité au métal. Un pH plus élevé du processus une plus grande résistance à la corrosion. La température accélère la réaction acide.
Le revêtement de différentes couleurs peut être appliqué, comme le bleu, le noir, l'or, le jaune et transparent. Il offre également une meilleure adhésion à la surface métallique vers les peintures et les adhésifs.
En surface érodée ou hachée
Des solutions d'acide chromique sont utilisées dans la préparation de la surface du matériau thermoplastique, des polymères thermosystibles et des élastomères pour un revêtement ultérieur avec des peintures ou des adhésifs.
Le H2Cro4 réalise un effet sur la chimie de surface et sa structure, car elle aide à augmenter sa rugosité. La combinaison des piqûres et de l'oxydation augmente la pénétration des adhésifs et peut même provoquer des changements dans les propriétés du polymère.
Il a été utilisé pour éroder le polyéthylène ramifié de basse densité, de haute densité et de polyéthylène linéaire en polypropylène.
Il est beaucoup utilisé dans l'industrie de l'électro-réception ou de la galvanoplastie pour faciliter l'adhérence en polymère métallique.
Dans plusieurs utilisations
L'acide chromique est utilisé comme conservateur en bois, également dans les matériaux magnétiques et pour les réactions chimiques catalyse.
Récupération d'acide cromique
Il existe de nombreux processus qui utilisent de l'acide chromique et génèrent des courants ou des résidus contenant du chrome (III) qui ne peuvent pas être rejetés car ils ont des ions chromés (VI) très toxiques, ou réutiliser parce que la concentration des ions chromate est très faible.
Sa disposition nécessite la réduction chimique des chromates au chrome (III), suivi des précipitations d'hydroxyde et de filtration, qui génère des coûts supplémentaires.
Pour cette raison, diverses méthodes ont été étudiées pour éliminer et récupérer les chromates. Voici quelques-uns de ces.
Grâce aux résines utilisées
Pendant de nombreuses années, des résines d'échange d'ions pour un traitement d'eau contaminé par chromat ont été utilisés. Ceci est l'un des traitements approuvés par la US Environmental Protection Agency, ou EPA (acronyme pour l'anglais Agence de Protection de l'Environnement).
Cette méthode permet la récupération de l'acide chromique concentré car il est à nouveau régénéré à partir de la résine.
Les résines peuvent être une base forte ou faible. Dans les résines fortement basiques, le chromate peut être supprimé sous forme d'ions HCRO4- et cr2SOIT72- Ils sont échangés avec des ions oh- et cl-. Dans les résines faiblement basiques, par exemple le sulfate, les ions sont échangés avec SOS42-.
Peut vous servir: népelométrieDans le cas de résines fortement basiques R- (OH), les réactions globales sont les suivantes:
2ROH + HCRO4- + H+ ⇔ R2Cro4 + 2h2SOIT
R2Cro4 + 2hcro4- ⇔ 2rhcro4 + Cro42-
R2Cro4 + HCRO4- + H+ ⇔ R2Croisement2SOIT7 + H2SOIT
Pour chaque mol de r2Cro4 La conversion d'une mole de Cr (VI) de la solution est supprimée, ce qui rend cette méthode très attrayante.
Après l'élimination des chromates, la résine est traitée avec une solution fortement alcaline pour les régénérer dans un endroit sûr. Ensuite, les chromates sont convertis en acide chromique concentré pour être réutilisé.
Par régénération électrochimique
Une autre méthode est la régénération électrochimique de l'acide chromique, qui est également une alternative très pratique. Grâce à cette procédure, le chrome (III) est oxydalement oxydé en chrome (VI). Le matériau d'anode dans ces cas est de préférence en dioxyde de plomb.
Utilisation de micro-organismes pour nettoyer les effluents avec des restes d'acide chromique
Une méthode qui a été étudiée et est toujours à l'étude est l'utilisation de micro-organismes présents naturellement dans certains effluents contaminés par des ions chromés hexavalents qui sont le contenu des solutions d'acide chromique.
 Effluents nuisibles pour l'environnement. Auteur: Vecteurs d'OpenClipart. Source: Pixabay.
Effluents nuisibles pour l'environnement. Auteur: Vecteurs d'OpenClipart. Source: Pixabay. C'est le cas de certaines bactéries présentes dans les eaux des eaux usées de bronzage. Ces microbes ont été étudiés et déterminés qu'ils résistent aux chromates et sont également capables de réduire le chrome (VI) en chrome (III), ce qui est beaucoup moins nocif pour l'environnement et les êtres vivants.
Pour cette raison, on estime qu'ils peuvent être utilisés comme une méthode environnementale pour l'assainissement et la détoxification des effluents contaminés par des restes d'acide chromique.
Risques d'acide chromique et oxyde chromique
Le CRO3 Ce n'est pas du carburant mais peut intensifier la combustion d'autres substances. Beaucoup de vos réactions peuvent provoquer du feu ou de l'explosion.
Le CRO3 et les solutions d'acide chromique sont une peau irritante puissante (elles peuvent provoquer une dermatite), les yeux (peuvent les brûler) et des muqueuses (peuvent provoquer une bronchasma) et peuvent provoquer les "creux chromés" appelés dans le système respiratoire.
Les composés chromés (VI) tels que l'acide chromique et l'oxyde chromique sont gravement toxiques, mutagènes et cancérigènes pour la plupart des êtres vivants.
Les références
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- OU.S. Bibliothèque nationale de médecine. (2019). Acide chromique. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Wegman, R.F. et Van Twisk, J. (2013). Alliages en aluminium et en aluminium. 2.5. Processus d'anodisation d'acide chromique. Dans les techniques de préparation de surface pour la liaison adhésive (deuxième édition). Récupéré de ScienceDirect.com.
- Wegman, R.F. et Van Twisk, J. (2013). Magnésium. 6.4. Préparation des alliages de magnésium et de magnésium par les processus de traitement de l'acide chromique. Dans les techniques de préparation de surface pour la liaison adhésive (deuxième édition). Récupéré de ScienceDirect.com.
- Grot, w. (2011). Applications. 5.1.8. Régénération d'acide chromique. Dans les ionomères fluorés (deuxième édition). Récupéré de ScienceDirect.com.
- Swift, k.g. et Booker, J.D. (2013). Processus d'ingénierie de surface. 9.7. Chromation. Dans le manuel de sélection des processus de fabrication. Récupéré de ScienceDirect.com.
- Poulson, un.H.C. et al. (2019). Techniques de modification de la surface du coup d'œil, y compris le traitement de surface du plasma. onze.3.2.1. Gravure de surface. Dans Peek Biomaterials Handbook (deuxième édition). Récupéré de ScienceDirect.com.
- Westheimer, F.H. (1949). Les mécanismes des oxydations d'acide chromique. Revues chimiques 1949, 45, 3, 419-451. Récupéré des pubs.ACS.org.
- Tan, H.K.S. (1999). Remue d'acide chromique par échange d'anions. The Canadian Journal of Chemical Engineering, Volume 77, février 1999. Récupéré de la bibliothèque en ligne.Wiley.com.
- Kabir, m.M. et al. (2018). Isolement et caractéristique des bactéries réductrices de chrome (VI) à partir d'effluents de tannerie et de déchets solides. Journal mondial de microbiologie et de biotechnologie (2018) 34: 126. NCBI a récupéré.NLM.NIH.Gouvernement.
- « Caractéristiques, éléments et exemples du paysage industriel
- Structure moléculaire acide cyanhydrique, propriétés, utilisations »

