Structure moléculaire acide cyanhydrique, propriétés, utilisations

- 1495
- 238
- Eva Henry
Il acide hydrocyanique o Le cyanure d'hydrogène est un composé organique dont la formule chimique est HCN. Il est également connu sous le nom de métanonitril.
L'acide cyanhydrique est un gaz incolore et extrêmement toxique, qui est obtenu lors du traitement des cyanures avec des acides. Cet acide est situé à l'intérieur de la graine pacifique, également connue dans de nombreux endroits comme une pêche.
 Graine de pêche, qui contient du cyanure d'hydrogène ou du cyanure d'hydrogène, HCN. Un.Ha [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons.
Graine de pêche, qui contient du cyanure d'hydrogène ou du cyanure d'hydrogène, HCN. Un.Ha [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons. À une température ambiante, moins de 25 ºC est un liquide et au-dessus de cette température est un gaz. Dans les deux cas, il est extrêmement toxique pour l'être humain, les animaux et même la majorité des micro-organismes qui ne s'y acclimatent pas. C'est un bon solvant pour les ions. Il est très instable car il a tendance à polymériser facilement.
Il se trouve dans le royaume végétal incorporé dans les molécules de certains glucosides, car lorsqu'ils sont hydrolysés par des enzymes du légume, le HCN, le glucose et le benzaldéhyde sont obtenus.
Ces glucosides se trouvent à l'intérieur des graines de certains fruits tels que les pêches, l'abricot, les cerises, les prunes et dans les amandes amères, donc elles ne devraient jamais être ingérées.
On le trouve également dans des plantes comme certains types de sorgho. De plus, certaines bactéries le produisent pendant leur métabolisme. Il est principalement utilisé dans la production de polymères et dans certains processus métallurgiques.
Le HCN est un poison mortel dû à l'inhalation, à l'ingestion et au contact. Il est présent dans la fumée de la cigarette et dans la fumée du feu des plastiques et des matériaux contenant du carbone et de l'azote. Il est considéré comme un polluant atmosphérique pour se produire pendant la combustion de matières organiques à partir de vastes zones de la planète.
[TOC]
Structure moléculaire et configuration électronique
Le cyanure d'hydrogène ou l'acide cyanure est un composé moléculaire covalent, avec un atome d'hydrogène, un carbone et un azote.
L'atome de carbone et d'azote partage 3 paires d'électrons, ils forment donc un triple lien. L'hydrogène est lié au carbone, qui avec cette union présente son Valencia de Cuatro et son octet électronique complet.
L'azote présente un Valencia de cinq et pour compléter son octet a une paire d'électrons disparus ou solitaires situés latéralement.
Le HCN est donc une molécule complètement linéaire, avec quelques électrons manquants situés latéralement dans de l'azote.
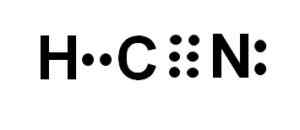 La représentation de Lewis de l'acide cyanhydrique, où les électrons partagés dans chaque liaison et la paire d'électrons azotés solitaires sont observés. Auteur: Marilú Stea.
La représentation de Lewis de l'acide cyanhydrique, où les électrons partagés dans chaque liaison et la paire d'électrons azotés solitaires sont observés. Auteur: Marilú Stea. 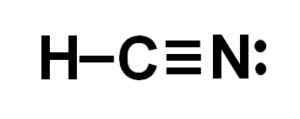 La structure du cyanure d'hydrogène ou du cyanure d'hydrogène où la triple liaison entre le carbone et l'azote est observée. Auteur: Marilú Stea.
La structure du cyanure d'hydrogène ou du cyanure d'hydrogène où la triple liaison entre le carbone et l'azote est observée. Auteur: Marilú Stea. Nomenclature
- Acide hydrocyanique
- Cyanure d'hydrogène
- Métanonitrile
- Formonitrile
- Acide hydrocyanique
Propriétés
État physique
En dessous de 25,6 ºC, s'il est anhydre et stabilisé, c'est un liquide bleu pâle très instable et toxique ou bleu. S'il est supérieur à cette température est un gaz incolore extrêmement toxique.
Poids moléculaire
27,03 g / mol
Point de fusion
-13.28 ºC
Point d'ébullition
25,63 ºC (notez qu'il bouillonne juste au-dessus de la température ambiante).
Point d'inflammation
-18 ºC (méthode de tasse fermée)
Température d'auto-direction
538 ºC
Peut vous servir: chromatographie en phase gazeuseDensité
0,6875 g / cm3 à 20 ºC
Solubilité
Totalement miscible avec l'eau, l'alcool éthylique et l'éther éthylique.
Constante de dissociation
K = 2,1 x 10-9
PAQUETpour = 9,2 (c'est un acide très faible)
Quelques propriétés chimiques
Le HCN a une constante diélectrique très élevée (107 à 25 ° C). En effet2SOIT.
Pour avoir une constante diélectrique aussi élevée, HCN se révèle être un bon solvant ionisant.
Le HCN anhydre liquide est très instable, il a tendance à polymériser violemment. Pour éviter cela, des stabilisateurs sont ajoutés, en petit pourcentage de H2Swin4.
En solution aqueuse et en présence d'ammoniac et de forme d'adénine à haute pression, un composé qui fait partie de l'ADN et de l'ARN, c'est-à-dire une molécule biologiquement importante.
C'est un acide très faible, car sa constante d'ionisation est très petite, il n'est donc que partiellement dans l'eau donnant à l'anion cyanure CN-. Former des sels avec les bases mais pas avec des carbonates.
Ses solutions aqueuses non protégées de la lumière sont lentement décomposées générant une forme d'ammonium hcoonh4.
En solution, il présente une odeur faible des amandes.
Corrosivité
Parce que c'est un acide faible, il n'est généralement pas corrosif.
Cependant, les solutions aqueuses HCN contenant de l'acide sulfurique comme stabilisateur attaquent fortement l'acier à des températures supérieures à 40 ºC et en acier inoxydable à des températures supérieures à 80 ° C.
De plus, les solutions aqueuses diluées HCN peuvent provoquer un acier au carbone même à température ambiante.
Vous pouvez également attaquer certains types de caoutchouc, de plastiques et de revêtements.
Emplacement dans la nature
Il est relativement abondant dans le royaume végétal qui fait partie des glucosides.
Par exemple, il est généré à partir de l'Emblissine C6H5-Ch (-cn) -o-glycose-glycose, composé présent dans les amandes amères. L'amygdale est une bêta-glucoside cyanogénique, car lorsqu'il est hydrolysisé, il forme deux molécules de glucose, une de benzaldéhyde et une de HCN. L'enzyme qui les libère est la bêta-glocoxydase.
L'amygdale peut être trouvée dans les graines des pêches, de l'abricot, des amandes amères, des cerises et des prunes.
Certains types de plantes de sorgho contiennent le glucó cyanogénique appelé Durrina (c'est-à-dire le p-hydroxy- (S) -Manlonitrilo-beta-d-glucoside). Ce composé peut être dégradé par une hydrolyse enzymatique à deux étapes.
Tout d'abord, l'enzyme Durrinosa qui est endogène dans les plantes de sorgho hydrolys avec du glucose et du p-hydroxy- (S) -Mandelonitrilo. Ensuite, ce dernier devient rapidement le HCN libre et le p-hydroxibenzaldéhyde.
 Plant de sorgho avec un contenu élevé Durrina. Aucun auteur lisible par machine fourni. Pethan a supposé (sur la base des réclamations du droit d'auteur). [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikipedia Commons.
Plant de sorgho avec un contenu élevé Durrina. Aucun auteur lisible par machine fourni. Pethan a supposé (sur la base des réclamations du droit d'auteur). [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikipedia Commons. HCN est responsable de la résistance des plantes de sorgho vers les ravageurs et les agents pathogènes.
Cela s'explique par le fait que la Durrina et l'enzyme de Durrinosa ont des emplacements différents dans ces plantes et entrent en contact uniquement lorsque les tissus sont blessés ou détruits, libérant le HCN et protégeant la plante d'infections qui pourraient pénétrer par la partie blessée.
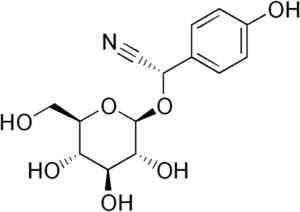 Molécule de durrina où la liaison triple CN est observée que par hydrolyse enzymatique produit du HCN. Edgar181 [domaine public]. Source: Wikipedia Commons.
Molécule de durrina où la liaison triple CN est observée que par hydrolyse enzymatique produit du HCN. Edgar181 [domaine public]. Source: Wikipedia Commons. De plus, certaines bactéries pathogènes de l'être humain comme Pseudomonas aeruginosa et P. Gingivalis Ils le produisent pendant leur activité métabolique.
Applications
Dans la préparation d'autres composés chimiques et polymères
L'utilisation impliquant la plupart des HCN produites au niveau industriel est la préparation des intermédiaires pour la synthèse organique.
Peut vous servir: Oxyde de fer (II): structure, nomenclature, propriétés, utilisationsIl est utilisé dans la synthèse adiponitrile nc- (ch2)4-CN, qui est utilisé pour préparer du nylon ou du nylon, un polyamide. Il sert également à préparer Acrilonitrilo ou Cianoéthylène Cho2= CH-CN, utilisé pour préparer les fibres en acrylique et en plastique.
Son cyanure de sodium dérivé est utilisé pour la récupération de l'or dans l'exploitation de ce métal.
Un autre de ses dérivés CLCN Le chlorure de cyanogène sert à des formules de pesticides.
Le HCN est utilisé pour la préparation d'agents chélateurs tels que l'EDTA (éthylen-diamino-tetra-acetato).
Il sert à la fabrication de ferrocyanures et de certains produits pharmaceutiques.
Diverses utilisations
Le gaz HCN a été utilisé comme insecticide, fongicide et désinfectant, pour la fumigation des navires et des bâtiments. Aussi pour fumiger les meubles afin de les restaurer.
HCN a été utilisé dans le vernis métallique.
Pour sa toxicité très élevée, il a été nommé agent de guerre chimique.
En agriculture
Il a été utilisé comme herbicide et pesticide dans les vergers. Il avait utilisé pour contrôler les échelles et autres agents pathogènes des agrumes, mais certains de ces ravageurs sont devenus résistants au HCN.
Il a également été utilisé pour fumiger les silos de grains. Le HCN gazeux préparé sur le site a été utilisé dans la fumigation des grains de blé pour les préserver des ravageurs tels que les insectes, les champignons et les rongeurs. Pour cette utilisation, il est essentiel que les graines soient fumigées à l'agent de pesticide.
Teste des graines de blé fumigantes ont été effectuées avec HCN et il a été constaté que le potentiel de germination de ceux-ci n'affecte pas négativement, il semble plutôt le favoriser.
Cependant, des doses élevées de HCN peuvent réduire considérablement la longueur des petites feuilles qui poussent de la graine.
D'un autre côté, en raison du fait qu'il s'agit d'un puissant nématicide et que certaines plantes de sorgho le possèdent dans leurs tissus, le potentiel des plantes de sorgho est étudié pour être utilisé comme engrais vert biocide.
Son utilisation servirait à améliorer les sols, à supprimer les mauvaises herbes et à contrôler les maladies et les dommages causés par les nématodes phytoparasitiques.
Des risques
Pour l'être humain, le HCN est un poison mortel sur toutes les routes: inhalation, ingestion et contact.
 Auteur: Clker-Free-Vector-Images. Source: Pixabay.
Auteur: Clker-Free-Vector-Images. Source: Pixabay. Inhalé peut être mortel. On estime qu'environ 60 à 70% de la population peut détecter l'odeur des amandes HCN amères lorsqu'elle est dans l'air à une concentration de 1 à 5 ppm.
Mais il y a 20% de la population qui ne peut encore pas le détecter à des concentrations mortelles pour être génétiquement incapable de le faire.
Ingéré est un poison à action aiguë et immédiate.
Si vos solutions entrent en contact avec la peau, le cyanure associé peut être mortel.
Le HCN est présent dans la fumée de cigarette et celui qui est généré lorsque les plastiques qui contiennent de l'azote sont brûlés.
Mécanisme d'action mortel au sein de l'organisme
C'est un produit chimique et est rapidement toxique, entraînant fréquemment la mort. En entrant dans l'organisme, il rejoint les métalloenzymes (enzymes qui contiennent un ion métallique) en les inactivant. C'est un agent toxique pour plusieurs organes du corps humain
Son principal effet toxique consiste à inhiber la respiration cellulaire, car il désactive une enzyme qui influence la phosphorylation dans les mitochondries, qui sont des organites qui interviennent, entre autres, dans la fonction respiratoire des cellules.
Peut vous servir: permanganate de potassium (KMNO4)Risque de fumée de cigarette
Le HCN est présent dans la fumée de cigarette.
Bien que beaucoup de gens connaissent l'effet de l'empoisonnement du HCN, peu de gens réalisent qu'ils sont exposés à leur effet nocif par la fumée de cigarette.
HCN est l'une des causes de l'inhibition de plusieurs enzymes respiratoires cellulaires. La quantité de HCN présente dans la fumée de cigarette a un effet nocif sur le système nerveux.
Des niveaux de HCN ont été signalés dans la fumée de cigarette entre 10 et 400 μg par cigarette pour la fumée directement et 0,006 à 0,27 μg / cigarette pour l'inhalation secondaire (fumeur passif). HCN produit des effets toxiques à partir de 40 μm.
 Auteur: Alexas Photos. Source: Pixabay.
Auteur: Alexas Photos. Source: Pixabay. Être inhalé entre rapidement dans la circulation sanguine, où il est libéré dans le plasma ou se lie à l'hémoglobine. Une petite partie se transforme en tiocianato et est excrétée par l'urine.
Risques de chauffage HCN
Une exposition prolongée à la chaleur du HCN liquide dans des conteneurs fermés peut provoquer une rupture violente et inattendue de celles-ci. Il peut polymériser de manière explosive 50 à 60 ºC en présence de traces alcalines et en l'absence d'inhibiteurs.
Présence de HCN dans la fumée de feu
Le HCN est libéré lors de la combustion de polymères qui contiennent de l'azote, comme la laine, la soie, les polyacrylonitrilos et le nylon, entre autres. Ces matériaux sont présents dans nos maisons et sur la plupart des sites d'activité humaine.
Pour cette raison, pendant les incendies, le HCN peut potentiellement être la cause du décès par inhalation.
Polluant de l'atmosphère
HCN est un polluant de la troposphère. Il résiste à la photoólyse et dans les conditions environnementales de l'atmosphère ne souffre pas d'hydrolyse.
OH Radicaux hydroxyles • Produit photochimiquement peut réagir avec le HCN, mais la réaction est très lente, donc la demi-vie du HCN dans l'atmosphère est de 2 ans.
Lorsque la biomasse brûle, en particulier la foule, HCN est libéré dans l'atmosphère, et aussi pendant les activités industrielles. Cependant, la combustion de tourbe est de 5 à 10 fois plus polluante que de brûler un autre type de biomasse.
Certains chercheurs ont constaté que des températures élevées et une sécheresse causées par le phénomène El Niño dans certaines régions de la planète exacerbent.
 Auteur: Steve Buisinne. Source: Pixabay.
Auteur: Steve Buisinne. Source: Pixabay. Cela conduit à une brûlure intense de biomasse dans les stations sèches.
Ces événements sont à l'origine de concentrations élevées de HCN dans la troposphère, qui sont finalement transportées vers la faible stratosphère, restant pendant très longtemps.
Les références
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- OU.S. Bibliothèque nationale de médecine. (2019). Cyanure d'hydrogène. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Gidlow, D. (2017). Cyanure d'hydrogène-une mise à jour. Médecine du travail 2017; 67: 662-663. NCBI a récupéré.NLM.NIH.Gouvernement.
- Encyclopédie scientifique de Van Nostrand. (2005). Cyanure d'hydrogène. 9e Récupéré de la bibliothèque en ligne.Wiley.com.
- Ren, et.-L. et al. (mille neuf cent quatre vingt seize). Effet du cyanure d'hydrogène et du sulfure carbonyle sur la germination et la vigueur de la plumule du blé. Pestique. SCI. 1996, 47, 1-5. Récupéré de la bibliothèque en ligne.Wiley.com.
- De Nicola, G.R. et al. (2011). À une méthode analytique simple pour l'évaluation du contenu du dhurrin dans les plantes cyanogéniques pour leur utilisation dans le fourrage et la biofumigation. J. Agrique. Chem alimentaire. 2011, 59, 8065-8069. Récupéré des pubs.ACS.org.
- Sheese, p.ET. et al. (2017). Une amélioration mondiale du cyanure d'hydrogène dans la stratosphère inférieure à travers 2016. Géophys. Bœuf. Let., 44, 5791-5797. Récupéré des agupubs.Bibliothèque en ligne.Wiley.com.
- Surleva, un.R. et drochioiu, g. (2013). Visualisation Hanger du tabagisme: simple détermination spectrophotométrique du cyanure d'hydrogène dans la fumée de cigarette et les filtres. J. Chem. Éduquer. 2013, 90, 1654-1657. Récupéré des pubs.ACS.org.
- Allarie, et. et al. (1990). Rôle du cyanure d'hydrogène dans la mort humaine dans le feu. Dans le feu et les polymères. chapitre 3. Série de symposium ACS. Récupéré des pubs.ACS.org.
- « Structure d'acide chromique, propriétés, obtention, utilisations
- 8 expériences avec des humains très controversés »

