Cellules électrochimiques

- 2022
- 253
- Jade Duval
Que sont les cellules électrochimiques?
Le cellules électrochimiques Ce sont des dispositifs dans lesquels les réactions chimiques passent où l'énergie chimique est transformée en électricité ou vice versa. Ces cellules constituent le cœur de l'électrochimie, l'âme étant l'échange potentiel d'électrons qui peuvent se produire, spontanés ou non spontanément, entre deux espèces chimiques.
L'une des deux espèces s'oxyde, perd des électrons, tandis que l'autre est réduit en gagnant les électrons cédés. Généralement, l'espèce réduite est un cation métallique en solution, qui en gagnant électriquement finit par être électriquement sur une électrode fabriquée au même métal. D'un autre côté, l'espèce qui oxyde est un métal, devenant des cations métalliques.
 Diagramme de cellules électrochimiques de Daniel. Source: rehua [cc by (https: // CreativeCommons.Org / licences / par / 3.0)]
Diagramme de cellules électrochimiques de Daniel. Source: rehua [cc by (https: // CreativeCommons.Org / licences / par / 3.0)] Par exemple, l'image supérieure représente la cellule de Daniel: la plus simple de toutes les cellules électrochimiques. L'électrode de zinc métallique est oxydée, libérant des cations Zn2+ à l'environnement aqueux. Cela se produit dans le conteneur ZNSO4 à partir de la gauche.
À droite, la solution contenant Cuo4 Il est réduit, transformant les cations cu2+ En cuivre métallique qui est déposé sur l'électrode en cuivre. Au cours du développement de cette réaction, les électrons parcourent un circuit externe activant leurs mécanismes; Et donc, fournir de l'électricité pour le fonctionnement d'un équipement.
Composants cellulaires électrochimiques
Électrodes
Dans les cellules électrochimiques sont générées ou consommées. Pour assurer un bon flux d'électrons, il doit y avoir des matériaux qui sont de bons conducteurs d'électricité. C'est là que les électrodes et le circuit externe viennent, assuré de câblage en cuivre, d'argent ou d'or.
Les électrodes sont les matériaux qui fournissent la surface où les réactions dans les cellules électrochimiques seront développées. Il y a deux types selon la réaction qui y survient:
- Anode, électrode où l'oxydation se produit.
- Cathode, électrode où la réduction se produit.
Les électrodes peuvent être faites d'un matériau de réaction, comme dans le cas de la cellule de Daniel (zinc et cuivre); ou, d'un matériau inerte, comme c'est le cas lorsqu'ils sont faits de platine ou de graphite.
Les électrons attribués par l'anode doivent atteindre la cathode; Mais pas à travers une solution, mais en parcourant un câble métallique qui rejoint les deux électrodes à un circuit externe.
Dissolution d'électrolyte
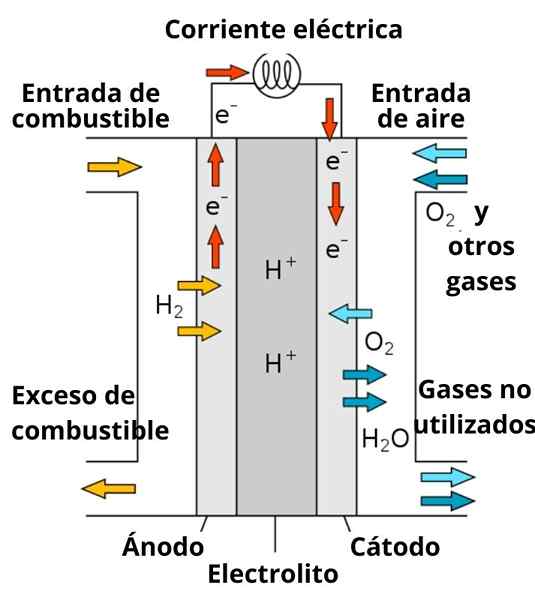 Schéma d'une batterie de carburant conducteur protons
Schéma d'une batterie de carburant conducteur protons La dissolution qui entoure les électrodes joue également un rôle important, car il est enrichi de forts électrolytes; comme: kcl, kno3, NaCl, etc. Ces ions favorisent dans une certaine mesure la migration des électrons de l'anode vers la cathode, ainsi que leur conduction au voisinage des électrodes pour interagir avec l'espèce pour réduire.
L'eau de mer, par exemple, conduit une bien meilleure électricité que l'eau distillée, avec une concentration d'ions inférieure. C'est pourquoi les cellules électrochimiques ont une solution d'électrolytes forts parmi leurs composants.
Pont saline
Les ions de la solution commencent à entourer les électrodes provoquant une polarisation des charges. La dissolution autour de la cathode commence à se charger négativement, car les cations sont réduites; Dans le cas de la cellule de Daniel, Cu cations2+ En déposant comme un cuivre métallique sur la cathode. Ainsi, il y a un déficit de charges positives.
C'est là que le pont salin intervient pour équilibrer les charges et empêcher les électrodes d'être polarisées. Sur le côté ou le compartiment des cations cathodiques du pont saline migreront, soit k+ ou Zn2+, Pour supplanter le Cu2+ consommé. Pendant ce temps, du pont saline migrera les anions et non3- Vers le compartiment anode, pour neutraliser la concentration croissante de cations Zn2+.
Il peut vous servir: dichromate de potassium: formule, propriétés, risques et utilisationsLe pont salin est composé d'une solution de sels saturés, avec ses extrémités recouvertes d'un gel ionique perméable, mais étanche pour l'eau.
Types de cellules électrochimiques et comment elles fonctionnent
La façon dont fonctionne une cellule électrochimique dépend du type qui est. Il existe fondamentalement deux types: galvanique (ou voltaïque) et électrolytique
Galvaniques
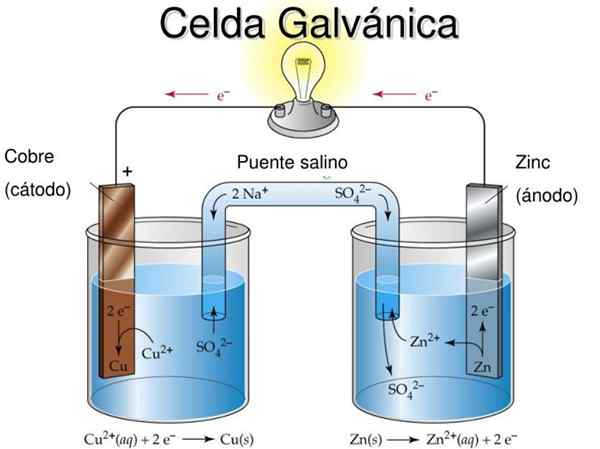
La cellule de Daniel est un exemple de cellule électrochimique galvanique. En eux, les réactions se produisent spontanément et le potentiel de la batterie est positif; Plus le potentiel est grand, plus l'électricité qui fournira la cellule.
Les batteries ou les batteries sont précisément des cellules galvaniques: le potentiel chimique entre les deux électrodes est transformé en énergie électrique lorsqu'un circuit externe intervient qui les relie. Ainsi, les électrons migrent de l'anode, éclairent l'équipement auquel la batterie est connectée et sont retournés directement à la cathode.
Électrolytique
Les cellules électrolytiques sont celles dont les réactions ne se produisent pas spontanément, sauf si elles sont fournies par l'énergie électrique à partir d'une source externe. Ici, le phénomène inverse se produit: l'électricité permet des réactions chimiques non spontanées pour se développer.
L'une des réactions les plus connues et précieuses qui se déroule dans ce type de cellule est l'électrolyse.
Les batteries rechargeables sont des exemples de électrolytiques et en même temps galvaniques: ils sont rechargés pour inverser leurs réactions chimiques et rétablir les conditions initiales pour réutiliser à nouveau.
Exemples
Cell de Daniel
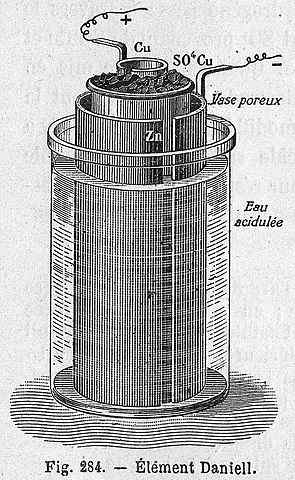 Schéma cellulaire de Daniel
Schéma cellulaire de Daniel L'équation chimique suivante correspond à la réaction de la cellule de Daniel où le zinc et le cuivre participe:
Peut vous servir: louer des halogénuros: propriétés, obtenir, exemplesZn (s) + Cu2+(aq) → Zn2+(aq) + cu (s)
Mais CU Cations2+ et Zn2+ Ils ne sont pas seuls mais accompagnés des anions SO42-. Cette cellule peut être représentée comme suit:
Zn | ZNSO4 | | Cuso4 | Cu
La cellule de Daniel peut être construite dans n'importe quel laboratoire, étant très récurrente en tant que pratique dans l'introduction de l'électrochimie. Comme cu2+ Il est déposé comme Cu, la couleur bleue de la solution CUSO4 Il sera perdu.
Platine et cellule d'hydrogène
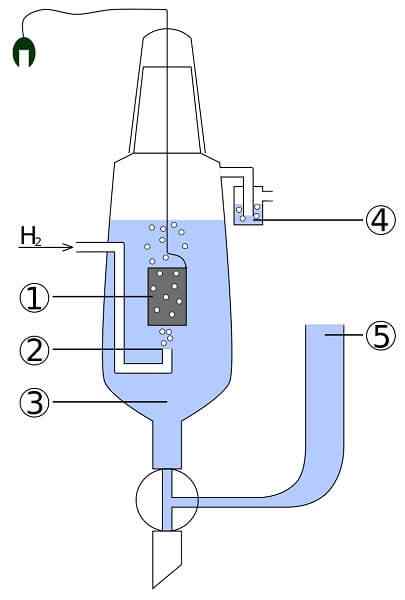 Schéma d'un platine et d'une cellule hydrogène: 1. 2 électrodes en platine. Hydrogène gaz 3. Solution acide 4. Hidroseal 5. Dépôt syndical
Schéma d'un platine et d'une cellule hydrogène: 1. 2 électrodes en platine. Hydrogène gaz 3. Solution acide 4. Hidroseal 5. Dépôt syndical Imaginez une cellule qui consomme de l'hydrogène gazeux, produit de l'argent métallique et en même temps qu'il prend de l'électricité. Il s'agit du platine et de la cellule d'hydrogène, et sa réaction générale est la suivante:
2agcl (s) + h2(g) → 2ag (s) + 2h+ + 2Cl-
Ici, dans le compartiment anode, nous avons une électrode en platine inerte, immergée dans l'eau et à laquelle l'hydrogène du gaz est pompé. Le H2 être oxydé à H+ et donne ses électrons au précipité laiteux d'Agcl dans le compartiment cathode avec une électrode en argent métallique. AGCL sera réduit sur cette argent et la pâte d'électrode augmentera.
Cette cellule peut être représentée comme:
PT, H2 | H+ | | CL-, AGCL | Agir
Downs cellule
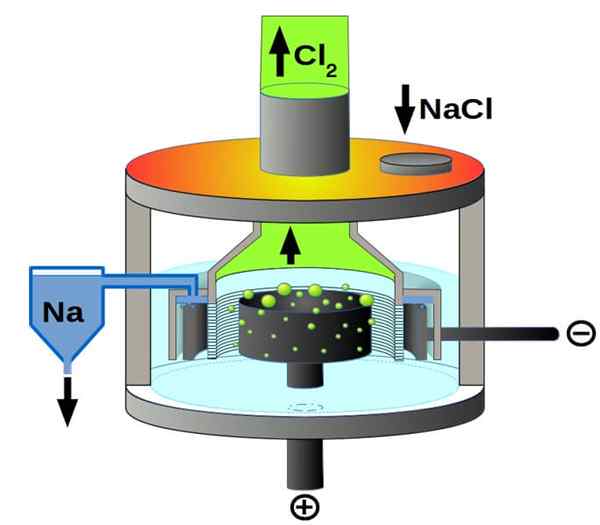 Schéma de cellules de Downs pour l'électrolyse du chlorure de sodium. Source: PCHEMIKER, CC BY-SA 4.0, via Wikimedia Commons
Schéma de cellules de Downs pour l'électrolyse du chlorure de sodium. Source: PCHEMIKER, CC BY-SA 4.0, via Wikimedia Commons Et enfin, parmi les cellules électrolytiques, nous avons le chlorure de sodium fondu, mieux connu sous le nom de cellule Downs. Ici, l'électricité est faite pour voyager à travers les électrodes un volume de NaCl en fusion, et leur apprend donc les réactions suivantes:
2e+(l) + 2e- → 2NA (s) (cathode)
2Cl-(L) → Cl2(g) + 2e- (anode)
2NaCl (L) → 2NA (S) + CL2(g) (réaction globale)
Ainsi, grâce à l'électricité et au chlorure de sodium, le sodium métallique et le chlore peuvent être préparés.

