Caractère métallique
- 847
- 64
- Raphaël Meyer
Quel est le caractère métallique?
Il Caractère métallique des éléments Le tableau périodique fait référence à toutes ces variables, chimiques et physiques, qui définissent les métaux ou les distinguent des autres substances de la nature. Ils sont généralement brillants, denses, durs, élevés thermiques et électriques, moulables et ductiles.
Cependant, tous les métaux ne présentent pas de telles caractéristiques; Par exemple, dans le cas du mercure, c'est un liquide noir brillant. De plus, ces variables dépendent de la pression terrestre et des conditions de température. Par exemple, l'hydrogène apparemment non métallique peut se comporter physiquement comme un métal dans des conditions extrêmes.
Ces conditions peuvent être: sous des pressions abyssales ou des températures très froides autour du zéro absolu. Pour définir si un élément est métallique ou non, il est nécessaire de considérer les motifs cachés dans les yeux de l'observateur: les motifs atomiques.
Ceux-ci discriminent plus de précision et de fiabilité quels sont les éléments métalliques, et même quel élément est plus métallique qu'un autre.
De cette façon, le véritable caractère métallique d'une pièce d'or repose davantage sur les qualités de ses atomes que celles déterminées par sa masse dorée, même les deux sont étroitement liés.
Laquelle des pièces est la plus métallique: une d'or, une de cuivre ou d'un platine? La réponse est le platine, et l'explication réside dans ses atomes.
Comment varie le caractère métallique des éléments dans le tableau périodique?
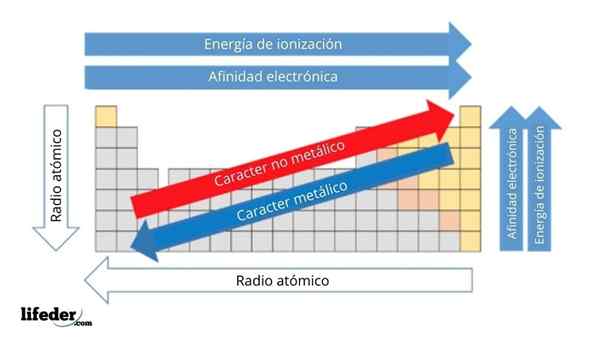
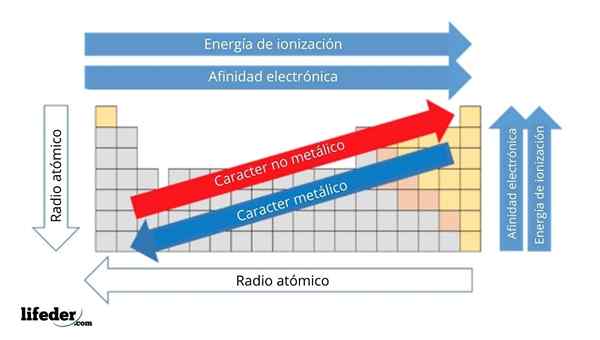
Dans l'image supérieure, vous avez les propriétés périodiques des éléments. Les lignes correspondent aux périodes et aux colonnes aux groupes.
Le caractère métallique diminue de gauche à droite du tableau périodique et augmente dans la direction opposée. De même, le caractère métallique augmente de haut en bas et diminue à mesure que les périodes sont voyagées dans les têtes de groupe.
Il peut vous servir: Bases: Caractéristiques et exemplesDe cette façon, les éléments qui sont proches de la direction dans laquelle les points de flèche ont un caractère métallique plus élevé que ceux situés dans la direction opposée (les blocs jaunes).
De plus, les autres flèches correspondent à d'autres propriétés périodiques, qui définissent dans quel sens ils augmentent ou diminuent à mesure que l'élément est "métallique". Par exemple, les éléments des blocs jaunes, bien qu'ils aient un faible caractère métallique, leur affinité électronique et leur énergie d'ionisation sont élevées.
Dans le cas des radios atomiques, plus, plus l'élément est métallique; Ceci est indiqué par la flèche bleue.
Propriétés des éléments métalliques
Dans le tableau périodique, il est observé que les métaux ont de grandes radios atomiques, de faibles énergies d'ionisation, de faibles affinités électroniques et de faibles électronégativités. Comment mémoriser toutes ces propriétés?
Le point auquel ils coulent est la réactivité (électropositivité) qui définit les métaux, qui s'oxydent; c'est-à-dire qu'ils perdent facilement les électrons.
Quand ils perdent des électrons, les métaux forment des cations (m+). Par conséquent, les éléments avec le caractère métallique le plus élevé forment des cations plus facilement que celles du caractère métallique inférieur.
Un exemple de ce qui précède est de considérer la réactivité des éléments du groupe 2, les métaux alcalinotherres. Le béryllium est moins métallique que le magnésium, et cela à son tour est moins métallique que le calcium.
Donc, jusqu'à atteindre le bario métallique, le plus réactif du groupe (après le rayon, élément radioactif).
Comment le rayon atomique sur la réactivité des métaux affecte-t-il?
À mesure que le rayon atomique augmente, les électrons de Valencia sont plus éloignés du noyau, ils sont donc retenus avec moins de force dans l'atome.
Peut vous servir: hydroxyde de sodium (NaOH): structure, propriétés, utilisations, synthèseCependant, si une période est voyagée sur le côté droit du tableau périodique, le noyau ajoute des protons à son corps, maintenant plus positif, qui attire plus fortement les électrons de valence, réduisant la taille du rayon atomique. Il en résulte une diminution du caractère métallique.
Ainsi, un très petit atome et avec un noyau très positif ont tendance à gagner des électrons au lieu de les perdre (éléments non métalliques), et ceux qui peuvent à la fois gagner et perdre des électrons sont considérés comme des métalloides. Boron, Silicon, Germanio et Arsenic sont quelques-uns de ces métalloïdes.
D'un autre côté, le rayon atomique augmente également s'il y a une nouvelle disponibilité énergétique pour d'autres orbitales, qui se produit lorsqu'ils descendent dans un groupe.
Pour cette raison, en descendant dans le tableau périodique, les radios deviennent volumineuses et le noyau devient incapable d'empêcher d'autres espèces de saisir les électrons de leur couche externe.
En laboratoire, avec un fort acide nitrique dilué comme un agent oxydant (HNO3) - Les réactivités métalliques face à l'oxydation peuvent être étudiées.
De même, les processus de formation de leurs halogénures métalliques (NaCl, par exemple) sont également des expériences démonstratives de cette réactivité.
Élément d'un plus grand caractère métallique
 Césium
Césium La direction de la flèche bleue à l'image du tableau périodique conduit aux éléments Francio et Cesio. Le Francio est plus métallique que le césium, mais contrairement à ce dernier, le Francio est artificiel et radioactif. Pour cette raison, le césium occupe la place de l'élément naturel d'un plus grand caractère métallique.
Peut vous servir: oxyde de ferEn fait, l'une des réactions connues les plus connues (et explosives) est celle qui se produit lorsqu'une pièce (ou gouttes) de césium entre en contact avec l'eau.
La forte réactivité du césium, également traduite par la formation de composés beaucoup plus stables, est responsable de la libération soudaine d'énergie:
2cs (s) + 2h2O → 2CSOH (aq) + h2(g)
L'équation chimique permet de voir l'oxydation du césium et la réduction de l'hydrogène de l'eau à l'hydrogène gazeux.
Élément du caractère métallique inférieur
 Modèle de fluor 3D
Modèle de fluor 3D Dans la diagonale opposée, dans le coin supérieur droit du tableau périodique, fluorure (F2, Image supérieure) mène la liste des éléments non métalliques. Parce que? Parce que c'est l'élément de la nature la plus électronégative et celle avec l'énergie d'ionisation la plus basse.
En d'autres termes, il réagit avec tous les éléments du tableau périodique pour former l'ion f- et pas f+.
Il est très peu probable que le fluor perde des électrons dans une réaction chimique, assez contraire aux métaux. C'est pour cette raison que c'est l'élément de caractère métallique inférieur.
Les références
- Lumen, chimie pour les non-majors. Caractère métallique et non métalllique. Récupéré des cours.Lumenarning.com
- Affectation en chimie. (2018). Électroposctivité ou caractère métallique. Récupéré de la chimie-assignation.com
- Juan Ramos. Liste complète des métaux et des non-métaux. Récupéré de ScienceTrends.com
- Anne Marie Helmestine, Ph.D. Propriétés et tendances du caractère métallique. Récupéré de Thoughtco.com

