Phosphate de magnésium (Mg3 (PO4) 2)
- 2591
- 600
- Raphaël Meyer
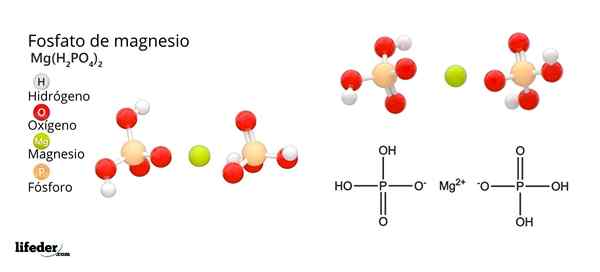
 Structure et formule du phosphate de magnésium
Structure et formule du phosphate de magnésium Qu'est-ce que le phosphate de magnésium?
Il Phosphate de magnésium C'est un terme qui est utilisé pour désigner une famille de composés inorganiques formés par du magnésium, du métal alcalin et du phosphate oxoanion. Le phosphate de magnésium le plus simple a une formule chimique MG3(Po4)2. La formule indique que pour deux anions Po43- Il y a trois cations mg2+ interagir avec ces.
De plus, ces composés peuvent être décrits comme des sels de magnésium dérivés de l'acide orthophosphatique (H3Pote4). En d'autres termes, le magnésium est "collecté" entre les anions phosphatés, quelle que soit sa présentation inorganique ou organique (MgO, Mg (non3)2, MGCL2, Mg (oh)2, etc.).
Pour ces raisons, les phosphates de magnésium peuvent être trouvés comme plusieurs minéraux. Certains d'entre eux sont: catteite -mg3(Po4)2 · 22h2O-, struvita - (nh4) Mgpo4· 6h2Ou, dont les microcristaux sont représentés dans l'image supérieure-, Holtedalita -mg2(Po4) (Oh) - et bobierrite -mg3(Po4)2· 8h2SOIT-.
Dans le cas de la Bobierrite, sa structure cristalline est monoclinique, avec des agrégats cristallins avec des ventilateurs et des rosettes massives. Cependant, les phosphates de magnésium se caractérisent par une présentation d'un riche produit chimique structurel, ce qui signifie que leurs ions adoptent de nombreux arrangements cristallins.
Formes de phosphate de magnésium et neutralité de leurs charges
Les phosphates de magnésium dérivent du remplacement des protons H3Pote4. Lorsque l'acide orthophosphorique perd un proton, il reste comme l'ion phosphate dihydrogène2Pote4-.
Comment neutraliser la charge négative pour provoquer un sel de magnésium? Oui Mg2+ Représente deux charges positives, puis a besoin de deux h2Pote4-. Ainsi, le magnésium diácido phosphate est obtenu, mg (h2Pote4)2.
Ensuite, lorsque l'acide perd deux protons, l'ion hydrogénphosphate reste, HPO42-. Maintenant comment neutraliser ces deux charges négatives? Comme le mg2+ Vous n'avez besoin que de deux charges négatives pour neutraliser, interagir avec un seul ion HPO42-. De cette façon, le phosphate d'acide de magnésium est obtenu: MGHPO4.
Peut vous servir: oxyde de magnésium: structure, propriétés, nomenclature, utilisationsEnfin, lorsque tous les protons sont perdus, l'anion phosphate reste43-. Cela nécessite trois cations mg2+ et d'un autre phosphate pour s'assembler dans un solide cristallin. L'équation mathématique 2 (-3) + 3 (+2) = 0 aide à comprendre ces proportions stoechiométriques pour le magnésium et le phosphate.
À la suite de ces interactions, le phosphate de magnésium tribasique est produit: mg3(Po4)2. Pourquoi le Tribasic? Parce qu'il est capable d'accepter l'équivalent de trois H+ Pour former à nouveau le H3Pote4:
Pote43-(AC) + 3H+(Ac) h3Pote4(AC)
Phosphates de magnésium avec d'autres cations
La compensation des charges négatives peut également être obtenue avec la participation d'autres espèces positives.
Par exemple, pour neutraliser le po43-, Les k ions+, N / A+, RB+, NH4+, etc., Ils peuvent également intercéder, formant le composé (x) MGPO4. Si x est égal à NH4+, Le minéral de la struvite anhydre est formé (NH4) Mgpo4.
Donner. Grâce à cela, de nombreux cristaux de phosphate de magnésium peuvent être synthétisés (Na3RBMG7(Po4)6, par exemple).
Structure

L'image supérieure illustre les interactions entre les ions Mg2+ et po43- qui définissent la structure cristalline. Cependant, ce n'est qu'une image qui démontre plutôt la géométrie tétraédrique des phosphates. Ensuite, la structure cristalline implique le phosphate et le magnésium sphères tétraèdre.
Dans le cas de Mg3(Po4)2 anhydre, les ions adoptent une structure rhomboédrique, dans laquelle le mg2+ est coordonné avec six atomes de o.
Ce qui précède est illustré dans l'image inférieure, avec la dimension que les sphères bleues sont du cobalt, les changeant juste pour les sphères vertes du magnésium:
Peut vous servir: alliages non ferreux: structure, propriétés, utilisations, exemples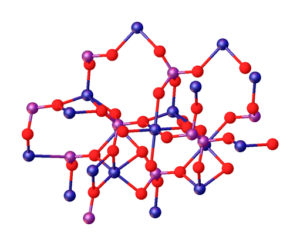
Juste au centre de la structure, Octaedro formé par les six sphères rouges autour de la sphère bleuâtre peut être située.
De plus, ces structures cristallines sont capables d'accepter les molécules d'eau, formant des hydrates de phosphate de magnésium.
En effet33-). De plus, chaque ion phosphate est capable d'accepter jusqu'à quatre ponts d'hydrogène; c'est-à-dire quatre molécules d'eau.
Comme le mg3(Po4)2 Il a deux phosphates, peut accepter huit molécules d'eau (ce qui se produit avec le minéral Bobierrite). À leur tour, ces molécules d'eau peuvent former des ponts d'hydrogène avec d'autres ou interagir avec les centres MG positifs2+.
Propriétés
C'est un solide blanc, formant des plaques rhombiques cristallines. Il n'a pas non plus d'odeur et de saveur.
Il est très insoluble dans l'eau, même lorsqu'il est chaud, en raison de sa grande énergie de réseau cristallin; Ceci est le produit des fortes interactions électrostatiques entre les ions polyvalents Mg2+ et po43-.
C'est-à-dire que lorsque les ions sont polyvalents et que leurs radios ioniques ne varient pas beaucoup en taille, le solide montre une résistance à sa dissolution.
Fond à 1184 ºC, ce qui indique également les interactions électrostatiques fortes. Ces propriétés varient en fonction du nombre de molécules d'absorber l'eau, et si le phosphate se trouve sous certaines de ses formes protonées (HPO42- ou h2Pote4-).
Utilisations / applications
Laxatif
Il a été utilisé comme laxatif pour les états de constipation et d'acidité gastrique. Cependant, ses effets secondaires nocifs - manifestés par la génération de diarrhée et de vomissements - ont limité leurs utilisations. De plus, il est susceptible de causer des dommages au tractus gastro-intestinal.
Peut vous servir: oxygène moléculaire: structure, propriétés, utilisationsRéparation des os
L'utilisation du phosphate de magnésium dans la réparation des tissus osseuses est actuellement à l'étude, étudiant l'application du Mg (H2Pote4)2 comme ciment.
Cette forme de phosphate de magnésium répond aux exigences à ce sujet: elle est biodégradable et histocompatible. De plus, son utilisation dans la régénération du tissu osseux est recommandée pour sa résistance et son réglage rapide.
Matériel pour l'orthopédie
L'utilisation du phosphate de magnésium amorphe (AMP) est évaluée comme du ciment orthopédique biodégradable et non exothermique. Pour générer ce ciment, la poudre d'ampli avec de l'alcool polyvinylique est mélangée, afin de former un mastic.
Dans les êtres vivants
La fonction principale du phosphate de magnésium est de servir de contribution Mg aux êtres vivants. Cet élément intervient dans de nombreuses réactions enzymatiques telles que le catalyseur ou l'intermédiaire, étant essentiel à la vie.
Une carence en Mg chez l'homme est associée aux effets suivants: diminution des niveaux d'AC, insuffisance cardiaque, rétention de NA, diminution des niveaux de K, arythmies, contractions musculaires soutenues, vomissements, nausées, faibles niveaux circulants d'hormones parathyroïdiens et d'estomac et de crampes menstruelles, entre autres.
Les références
- Publication de données minérales. (2001-2005). Bobierrite. Récupéré du manuel de laminaogie.org
- Mousa sahar. (2010). Étude sur la synthèse des matériaux de phosphate de magnésium. Bulletin de recherche en phosphore vol. 24, pp 16-21.
- Wikipédia. (2018). Magnésium phosphate tribasique. Récupéré de.Wikipédia.org
- Se publier. (2018). Magnésium phosphate anhydre. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement
- Barbie, e., Lin, B., Goel, V.K. Et bhaduri, s. (2016) Évaluation du ciment orthopédique non exothermique basé sur le phosphate de magnésium amorphe (AMP). Tapis biomédical. Volume 11 (5): 055010.
- Yu, et., Yu, ch. Et dai, h. (2016). Préparation du ciment osseux de magnésium dégrable. Biomatériaux régénératifs. Volume 4 (1): 231

