Électron différentiel

- 1210
- 238
- Prof Noah Collet
Il électron différentiel o Le différenciateur est le dernier électron placé dans la séquence de la configuration électronique d'un atome. Quel est ton nom? Pour répondre à cette question, il est nécessaire de connaître la structure de base d'un atome: son noyau, le vide et les électrons.
Le noyau est un agrégat dense et compact de particules positives appelées protons et de particules neutres appelées neutrons. Les protons définissent le nombre atomique Z et, avec les neutrons, composent la masse atomique. Cependant, un atome ne peut pas porter uniquement des charges positives; Par conséquent, les électrons orbitent autour du noyau pour le neutraliser.
 Structure d'atome de base: particules subatomiques principales
Structure d'atome de base: particules subatomiques principales Ainsi, pour chaque proton qui s'ajoute au noyau, un nouvel électron est incorporé dans ses orbitales pour contrer la charge positive croissante. De cette façon, le nouvel électron ajouté, l'électron différentiel, est étroitement lié au numéro atomique Z.
L'électron différentiel se trouve dans la couche électronique la plus externe: la couche de valence. Par conséquent, plus le noyau est possible, plus l'énergie qui lui est associée est grande. Cette énergie est responsable de sa participation, ainsi que de celle du reste des électrons de Valencia, dans les réactions chimiques caractéristiques des éléments.
[TOC]
Nombres quantiques
En plus du reste des électrons, l'électron différentiel peut être identifié par ses quatre nombres quantiques. Mais quels sont les nombres quantiques? Ils sont "n", "l", "m" et "s".
Le nombre quantique "n" désigne la taille des niveaux d'atome et d'énergie (k, l, m, n, ou, p, q). "L" est le nombre quantique secondaire ou acémutal, qui indique la forme des orbitales atomiques, et prend des valeurs de 0, 1, 2 et 3 pour les orbitales "S", "P", "D" et "F ", respectivement.
Il peut vous servir: Flash aphorié: caractéristiques, à quoi sert, types, utilisations"M" est le nombre quantique magnétique et indique l'orientation spatiale des orbitales sous un champ magnétique. Ainsi, 0 pour les "S" orbitaux; -1, 0, +1, pour l'orbital "p"; -2, -1, 0, +1, +2, pour l'orbital «d»; et -3, -2, -1, 0, +1, +2, +3, pour l'orbital «f». Enfin, le nombre quantique de spin «s» (+1/2 pour ↑ et -1/2 pour ↓).
Par conséquent, un électron différentiel a associé les nombres quantiques précédents ("n", "l", "m", "s"). Parce qu'il contrecarre la nouvelle charge positive générée par le proton supplémentaire, il fournit également le numéro atomique Z de l'élément.
Comment connaître l'électron différentiel?
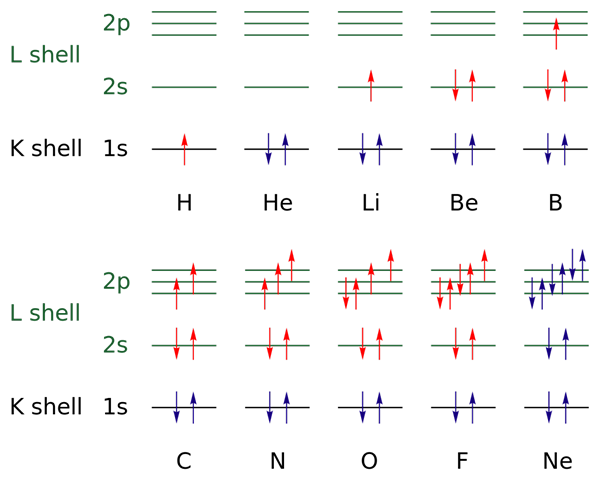
Dans l'image supérieure, les configurations électroniques sont représentées pour les éléments de l'hydrogène au gaz néon (H → NE).
En cela, les électrons des couches ouvertes sont indiqués par la couleur rouge, tandis que ceux des couches fermées sont indiquées avec la couleur bleue. Les couches se réfèrent au numéro quantique "n", le premier des quatre.
De cette façon, la configuration de Valencia du H (↑ du rouge) ajoute un autre électron avec une orientation opposée pour devenir celle du HE (↓ ↑, les deux bleus car maintenant le niveau 1 est fermé). Cet électron ajouté est alors l'électron différentiel.
Ainsi, on peut observer comment l'électron différentiel s'ajoute à la couche de valence (flèches rouges) des éléments, en les différenciant les uns des autres. Les électrons remplissent les orbitales concernant la règle du puits et le principe d'exclusion de Pauling (parfaitement observé de B au NE).
Et qu'en est-il des nombres quantiques? Ceux-ci définissent chaque flèche - c'est-à-dire chaque électron - et ses valeurs peuvent être corroborées avec la configuration électronique pour savoir si celles de l'électron différentiel sont ou non ou non.
Il peut vous servir: quels sont les effets négatifs que nous avons avec la solubilité dans l'eau?Exemples d'électrons différentiels dans plusieurs éléments
Chlore
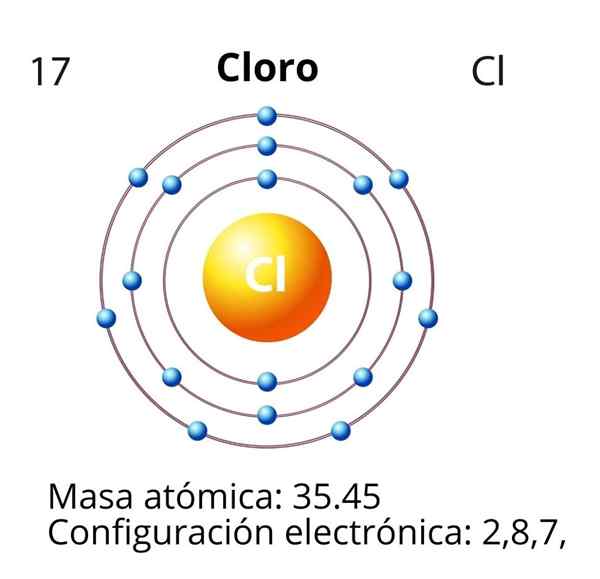
Dans le cas du chlore (Cl), son nombre atomique Z est égal à 17. La configuration électronique est alors 122s2sp63s23p5. Les orbitales marquées en rouge correspondent à celles de la couche de valence, qui présente le niveau 3 ouvert.
L'électron différentiel est le dernier électron qui est placé dans la configuration électronique, et l'atome de chlore est celui de l'orbitale 3p, dont la disposition est la suivante:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
En respectant la règle du puits, les orbitales 3p sont d'abord remplies d'énergie égale (une flèche ascendante dans chaque orbitale). Deuxièmement, les autres électrons s'accouplent avec des électrons à gauche solitaire. L'électron différentiel est représenté dans un cadre vert.
Ainsi, l'électron différentiel pour le chlore a les numéros quantiques suivants: (3, 1, 0, -1/2). C'est-à-dire que "n" est 3; "L" est 1, orbital "P"; "M" est 0, car c'est le "P" orbital du milieu; Et "S" est -1/2, puisque la flèche pointe vers le bas.
Magnésium
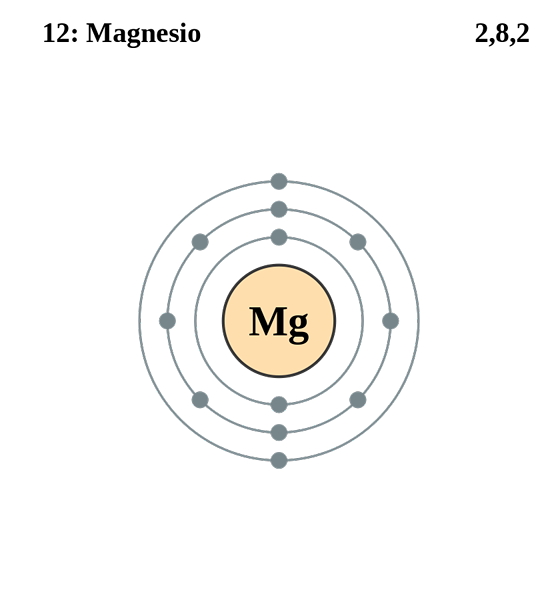 Configuration de magnésium électronique. Source: electron_shell_012_magnesium.SVG: Pumbaa (travail original de Greg Robson) Travail dérivé: Kizar, CC BY-SA 3.0, via Wikimedia Commons
Configuration de magnésium électronique. Source: electron_shell_012_magnesium.SVG: Pumbaa (travail original de Greg Robson) Travail dérivé: Kizar, CC BY-SA 3.0, via Wikimedia Commons La configuration électronique de l'atome de magnésium est 122s2sp63s2, Représentant l'orbital et son électron Valencia de la même manière:
↑ ↓
3s
0
Cette fois, l'électron différentiel a des numéros quantiques 3, 0, 0, -1/2. La seule différence dans ce cas en ce qui concerne le chlore est que le nombre quantique "L" est 0 parce que l'électron occupe un "S" orbital (le 3S).
Zirconio
La configuration électronique de l'atome de zirconium (transition métal) est 122s2sp63s23p64s23Ddix4p65s24d2. De la même manière que les cas précédents, la représentation des orbitales et des électrons de Valence est la suivante:
Il peut vous servir: Cyclopentano (C5H10): Structure, propriétés et utilisations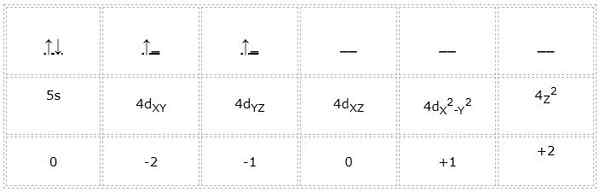
Ainsi, les nombres quantiques pour l'électron différentiel marqué en vert sont: 4, 2, -1, +1/2. Ici, comme l'électron occupe la deuxième orbitale "D", il a un nombre quantique "M" égal à -1. De plus, parce que la flèche pointe vers le haut, son numéro de spin "S" est égal à +1/2.
Élément inconnu
Les nombres quantiques de l'électron différentiel pour un élément inconnu sont 3, 2, +2, -1/2. Quel est le numéro atomique Z de l'élément? Connaître Z peut déchiffrer quel est l'élément.
Cette fois, car "n" est le même 3, cela signifie que l'élément se trouve dans la troisième période du tableau périodique, avec des orbitales "d" comme couche de valence ("l" égal à 2). Par conséquent, les orbitales sont représentées comme dans l'exemple précédent:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Les nombres quantiques "M" égaux à +2 et "S" égaux à -1/2 sont essentiels pour localiser correctement l'électron différentiel dans la dernière orbitale 3D.
Ainsi, l'élément recherché a des orbitales 3Ddix Plein, comme ses couches électroniques internes. En conclusion, l'élément est le zinc métallique (Zn).
Cependant, les nombres quantiques de l'électron différentiel ne peuvent pas discerner entre le zinc et le cuivre, car ce dernier élément présente également des orbitales 3D. Parce que? Parce que le cuivre est un métal qui échoue avec les règles remplies d'électrons pour des raisons quantiques.
Les références
- Jim Branson. (2013). Les règles de l'éniation. Récupéré de QuantumMechanics.UCSD.Édu
- Conférence 27: Règles de Sink. Récupéré du pH.Qmul.CA.ROYAUME-UNI
- Université Purdue. Nombres quantiques et configurations d'électrons. Récupéré de Murmed.Chem.Purger.Édu
- Encyclopédie de la science salvat. (1968). Salvat Physics, S.POUR. of Pampelua Editions, Volume 12, Espagne, p. 314-322.
- Walter J. Moore. (1963). Chimie physique. Dans Particules et vagues. Quatrième édition, Longmans.

