Notation nucléaire du carbone 12, histoire, commentaires
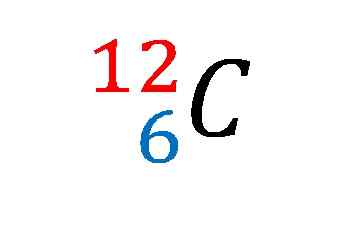
- 2085
- 200
- Jade Duval
Il Carbone-12 C'est l'isotope le plus abondant de l'élément de carbone, avec une abondance de 98,93%. De plus, il est principal responsable de toutes les propriétés et applications attribuées à l'élément carbone.
Il 12C avec une masse atomique de 12 Dalton exactement, il sert de référence à l'établissement des masses atomiques du reste des nucléides. L'atome de 12C se compose de six protons, neutrons et électrons; Cependant, la masse d'électrons est considérée comme négligeable.
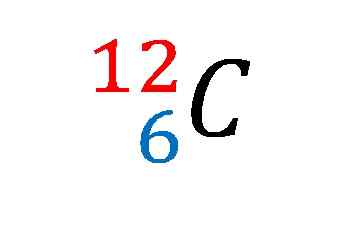 Notation nucléaire pour l'isotope de carbone-12. Source: Gabriel Bolívar
Notation nucléaire pour l'isotope de carbone-12. Source: Gabriel Bolívar Les éléments ont généralement des masses atomiques exprimées sous forme de nombres entiers, suivis des décimales, car les éléments peuvent avoir plusieurs isotopes stables.
Par conséquent, les masses atomiques des éléments sont exprimées comme la moyenne pondérée des masses atomiques de leurs différents isotopes. En tenant compte que le 12C a une abondance de 98,93% et le 13C Une abondance de 1,15%, la masse atomique du carbone est de 12 011 Dalton.
La masse atomique d'un élément est exprimée comme la moyenne des masses atomiques de ses différents atomes par rapport aux douze parties de la masse du 12C, connu comme une unité unifiée de masse atomique; Auparavant abrégé en "uma", et actuellement "u".
[TOC]
Notation nucléaire
Dans l'image supérieure, la notation ou le symbole nucléaire de l'isotope en carbone-12 a été montré.
Le décrire est la même chose que de s'asseoir les caractéristiques de l'atome de carbone par excellence. Son numéro atomique 6 indique le nombre de protons dans son noyau. Le nombre 12 est égal à la somme des protons et des neutrons, et donc il s'agit de masse atomique; qui est proportionnel à la masse nucléaire.
Peut vous servir: oxyde de ferEt bien que cette notation ne le montre pas, il existe 6 électrons qui contrecarrent la charge positive des protons dans le noyau. Du point de vue des liaisons chimiques, quatre de ces six électrons sont ceux qui établissent les fondements de la vie tels que nous le connaissons.
Histoire
Les enquêtes de Dalton (1810) ont souligné que l'eau contenait un pourcentage d'oxygène de 87,7% et 12,5% d'hydrogène. Mais, Dalton a dit que la formule d'eau était oh. Davy et Berzelius (1812) ont corrigé la formule de l'eau à H2SOIT.
Par la suite, Berzelius a trouvé une composition de l'eau suivante: oxygène 88,8% et hydrogène 11,2%. Il considérait que le poids atomique de l'hydrogène est de 1 g et l'oxygène de 16 g.
Ensuite, ils ont réalisé qu'en utilisant le poids atomique de 1 g pour l'hydrogène, le poids atomique de l'oxygène serait de 15,9 g. Cette raison, entre autres, a conduit à établir la masse atomique de 16 g d'oxygène comme norme de référence pour les masses atomiques des différents éléments chimiques.
L'oxygène a été utilisé comme modèle de référence de la fin du 19e siècle jusqu'en 1961, date à laquelle il a été décidé d'utiliser le carbone comme norme de référence pour l'établissement des masses atomiques des différents éléments.
Avant 1959, l'IUPAP et l'IUPAC ont utilisé l'élément d'oxygène pour définir la mol de la manière suivante: 1 mol est le nombre d'atomes d'oxygène présents dans 16 g.
Observations générales
Parler de 12C doit se référer au carbone dans son ensemble; ou du moins, 98% de son essence, ce qui est suffisant pour une telle approximation. C'est pourquoi cet isotope manque d'utilisation en soi, tandis que l'élément en tant que tel, et les solides qui intègrent des centaines d'applications.
Peut vous servir: solutions appréciéesCependant, il convient de noter que les organismes vivants ont une préférence particulière pour cet isotope que par le 13C; c'est-à-dire le pourcentage de 13C ou la relation 12C /13C varie en fonction des écosystèmes, des régions ou des espèces animales.
Cela peut être dû au fait que les molécules avec trop d'atomes 13C, plus lourd, gênant ou nuire aux processus métaboliques et le fonctionnement des cellules corporelles; même si le pourcentage de 13C Dans les êtres vivants, c'était un peu supérieur à 1%.
Par conséquent, la 12C est l'isotope du carbone responsable de la vie. Et le 14C Le «compteur de temps» de ses restes, grâce à sa décroissance radioactive.
Une autre utilité indirecte de 12C doit créer un «contraste» pour la technique de spectroscopie de résonance magnétique nucléaire de la technique 13C, avec lequel la structure gazéifiée des composés organiques peut être élucidée (découvrir et construire).
Les références
- Phillips, basilic. (8 juillet 2019). Quel est l'isotope du carbone incontournable? Science.com. Récupéré de: science.com
- César Tomé López. (2019). De poids atomiques. Récupéré de: Culturacientifica.com
- Elsevier. (2019). Carbone-12. ScienceDirect. Récupéré de: ScienceDirect.com
- R. bateau. (s.F.). Notation nucléaire. Récupéré de: hyperphysique.Phy-asch.GSU.Édu
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- « Caractéristiques du groupe carbonyle, propriétés, nomenclature, réactivité
- Biographie de Herberto Frías, style, œuvres »

