Caractéristiques du groupe carbonyle, propriétés, nomenclature, réactivité
- 2817
- 785
- Noa Da silva
Il Groupe de carbonyle Il s'agit d'un groupe fonctionnel organique et oxygéné qui ressemble à la molécule de gaz monoxyde de carbone. Il est représenté comme C = O, et bien qu'il soit considéré comme organique, il peut également être trouvé dans les composés inorganiques; Comme l'acide carbonique, h2CO3, ou dans des composés organométalliques avec du CO comme liaison.
Cependant, c'est en chimie du carbone, la vie, la biochimie et d'autres branches scientifiques analogues où ce groupe se distingue par son énorme importance. Si ce n'était pas pour lui, de nombreuses molécules ne pouvaient pas interagir avec l'eau; Les protéines, sucres, acides aminés, graisses, acides nucléiques et autres biomolécules n'existeraient pas si ce n'était pas pour elle.
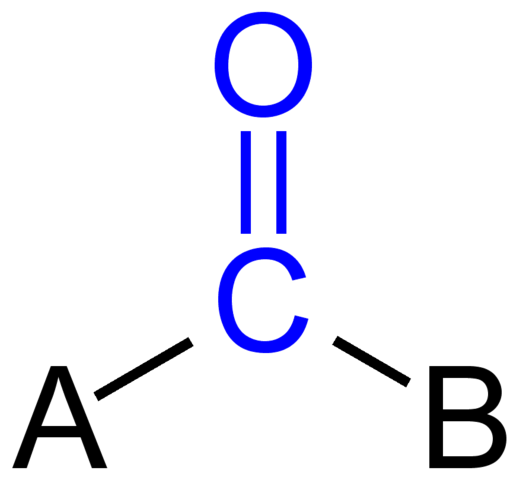
 Groupe de carbonyle. Source: Jü [domaine public]
Groupe de carbonyle. Source: Jü [domaine public] L'image supérieure montre à quoi ressemble ce groupe dans le squelette général d'un composé. Notez qu'il est mis en évidence par la couleur bleue, et si nous supprimons les remplacements A et B (R ou R ', également valides), il y aurait une molécule de monoxyde de carbone. La présence de ces substituants définit un grand nombre de molécules organiques.
Si A et B sont des atomes de carbone, tels que des métaux ou des éléments non métalliques, des composés organométalliques ou inorganiques peuvent être fabriqués. Dans le cas de la chimie organique, les substituants A et B seront toujours ou des atomes d'hydrogène, des lignes gazeuses, avec ou sans ramifications, cycliques ou anneaux aromatiques.
Ainsi, il commence à comprendre pourquoi le groupe carbonyle est assez courant pour ceux qui étudient les sciences naturelles ou de la santé; C'est partout, et sans elle les mécanismes moléculaires qui se produisent dans nos cellules ne se produiraient pas.
Si sa pertinence pouvait être résumé, il serait dit qu'il fournit une polarité, une acidité et une réactivité à une molécule. Lorsqu'il y a un groupe carbonyle, il est plus que probable qu'à ce moment-là, la molécule peut subir une transformation. Par conséquent, c'est un site stratégique pour développer une synthèse organique à travers des oxydations ou des attaques nucléophiles.
[TOC]
Caractéristiques et propriétés du groupe carbonyle
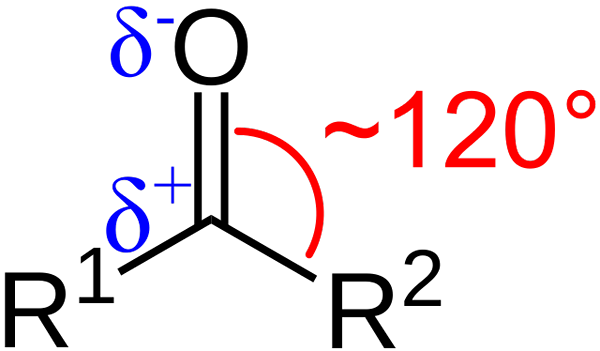 Caractéristiques structurelles du groupe carbonyle. Source: Azaline Gomberg [domaine public].
Caractéristiques structurelles du groupe carbonyle. Source: Azaline Gomberg [domaine public]. Quelles sont les caractéristiques structurelles et électroniques du groupe carbonyle? En haut1 et r2 Au lieu de A et B, qui existe entre les substituants et l'atome d'oxygène un angle de 120 ° C; C'est-à-dire que la géométrie autour de ce groupe est plate trigonale.
Quelle est la géométrie telle2; Ainsi, le carbone aura trois orbitales SP2 Pour former des liens covalents simples avec R1 et r2, et une orbitale p pur pour établir la double liaison avec l'oxygène.
De cette façon, il est expliqué comment il peut y avoir une double liaison c = o.
Si l'image est observée, on verra également que l'oxygène a une plus grande densité électronique, δ-, que le carbone, δ+. En effet, l'oxygène est plus électronégatif que le carbone et «vole» de la densité électronique; Et non seulement pour lui, mais aussi aux substituants r1 et r2.
Par conséquent, un moment dipolaire permanent est généré, qui peut être de plus ou moins ampleur en fonction de la structure moléculaire. Là où il y a un groupe carbonyle, il y aura des moments dipolaires.
Structures de résonance
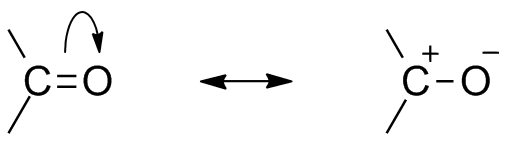 Les deux structures de résonance pour ce groupe organique. Source: Mfomich [CC0]
Les deux structures de résonance pour ce groupe organique. Source: Mfomich [CC0] Une autre conséquence de l'électronégativité de l'oxygène est que dans le groupe carbonyle, il existe des structures de résonance qui définissent un hybride (la combinaison des deux structures de l'image supérieure). Notez que la paire d'électrons peut migrer vers l'orbital p d'oxygène, qui laisse l'atome de carbone avec une charge partielle positive; Un carbocation.
Peut vous servir: cycloalcanos: propriétés, réactions, utilisations, exemplesLes deux structures se produisent constamment, donc le carbone maintient une carence constante des électrons; c'est-à-dire que pour les cations qui en sont très proches, ils connaîtront une répulsion électrostatique. Mais, s'il s'agit d'un anion ou d'une espèce capable de donner des électrons, il ressentira une forte attraction pour ce carbone.
Alors ce que l'on appelle l'attaque nucléophile se produit, qui sera expliquée dans une section suivante.
Nomenclature
Lorsqu'un composé a le groupe C = O, on dit qu'il est carbonyle. Ainsi, selon la nature du composé carbonyle, il a ses propres règles de nomenclature.
Bien que, quel que soit ce qui est, tout le monde partage une règle en commun: le C = O a une priorité dans la chaîne gazéifiée au moment de l'inscription des atomes de carbone.
Cela signifie que s'il y a des ramifications, des atomes halogènes, des groupes fonctionnels azrogènes, des liens doubles ou triples, aucun d'entre eux ne peut porter un nombre plus petit que C = O; Par conséquent, la chaîne la plus longue commence à être répertoriée aussi près que possible du groupe carbonyle.
Si au contraire il y a plusieurs c = ou dans la chaîne, et l'un d'eux fait partie d'un groupe fonctionnel de plus grande hiérarchie, alors le groupe carbonyle portera un localisateur plus grand et sera mentionné comme un substituant oxo.
Et qu'est-ce qui est dit hiérarchie? Ce qui suit, du plus haut à mineur:
-Acides carboxyliques, rcooh
-Ester, rcoor '
-Amida, RCONH2
-Aldéhyde, rcoh (ou rcho)
-Cetona, rcor
Remplacement R et R 'par des segments moléculaires, des composés carbonyle sans fin représentés par les familles ci-dessus: acides carboxyliques, esters, amidas, etc. Chacun a associé sa nomenclature traditionnelle ou son IUPAC.
Réactivité
Attaque nucléophile
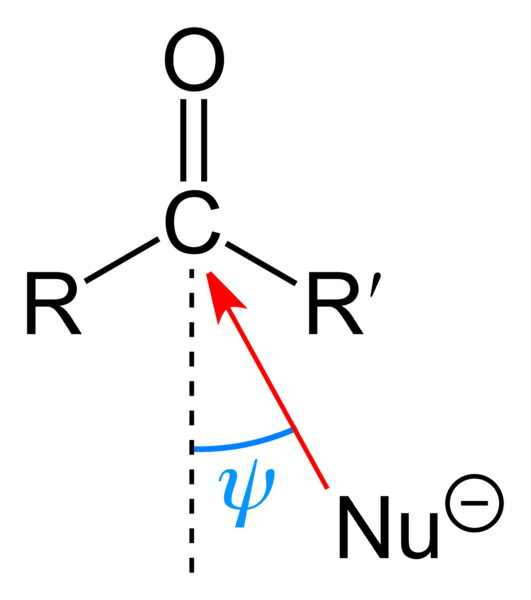 Attaque nucléophile contre le groupe carbonyle. Source: Benjah-Bmm27 [domaine public]
Attaque nucléophile contre le groupe carbonyle. Source: Benjah-Bmm27 [domaine public] L'image supérieure montre l'attaque nucléophile subie par le groupe carbonyle. Le nucléophile, Nu-, Il peut s'agir d'un anion ou d'une espèce neutre avec des électrons disponibles; Comme l'ammoniac, NH3, par exemple. Cela semble exclusivement au carbone car, selon les structures de résonance, il présente une charge partielle positive.
La charge positive attire Nu-, qui cherchera à aborder un «flanc» de sorte qu'il y a le moindre obstacle stérique par les substituants r et r '. Selon leur volume, ou la taille du même Nu-, L'attaque se produira sous différents angles ψ; Il peut être très ouvert ou fermé.
Une fois que l'attaque a eu lieu, un composé intermédiaire sera formé, nu-cr'-o-; c'est-à-dire que l'oxygène reste avec quelques électrons pour permettre à Nu d'être ajouté- au groupe carbonyle.
Cet oxygène chargé négativement peut intervenir dans d'autres étapes de la réaction; Proton en tant que groupe hydroxyle, OH, ou libérer comme une molécule d'eau.
Peut vous servir: coefficient de partition: distribution, distribution, applicationsLes mécanismes impliqués, ainsi que les produits de la réaction obtenus par cette attaque, sont très variés.
Dérivés
L'agent nublyic nu- Il peut s'agir de nombreuses espèces. Pour chaque spécifique à réagir avec le groupe carbonyle, différents dérivés.
Par exemple, lorsque ledit agent nucléophile est une amine, NH2A, iminas originaire, R2C = nr; S'il s'agit d'hydroxylamine, NH2Oh, entraîne des oxymatiques, rr'c = noh; Si c'est l'anion cyanure, CN-, Cianohydrinas, rr'c (oh) cn, et donc avec d'autres espèces.
Réduction
Au début, il a été dit que ce groupe est oxygéné, et donc rouillé. Cela signifie que, étant donné les conditions, les liens peuvent être réduits ou perdre l'atome d'oxygène le remplaçant par des hydrogènes. Par exemple:
C = o => ch2
Cette transformation indique que le groupe carbonyle a été réduit en un groupe de méthylène; Il y avait un gain d'hydrogène en raison de la perte d'oxygène. En termes chimiques plus appropriés: le composé carbonyle est réduit à un alcane.
S'il s'agit d'un cetona, rcor ', en présence d'hydraracina, h2N-nh2, et un environnement fortement basique peut être réduit à son alcane respectif; Cette réaction est connue sous le nom de réduction de Wolff-Kishner:
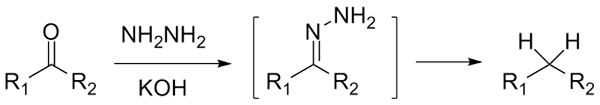 Réduction de Wolff-Kishner. Source: Jü [CC0]
Réduction de Wolff-Kishner. Source: Jü [CC0] Si, en revanche, le mélange réactionnel se compose d'amalgame du zinc et de l'acide chlorhydrique, la réaction est connue sous le nom de réduction de Clemmensen:
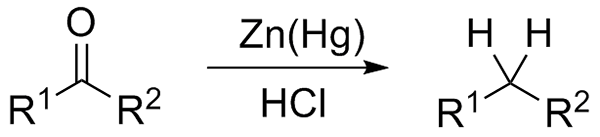 Réduction de Clemmensen. Source: Wikimedia Commons.
Réduction de Clemmensen. Source: Wikimedia Commons.
Formation acétale et CEAL
Le groupe carbonyle peut non seulement ajouter des agents nucléophiles Nu-, Mais dans des conditions acides, il peut également réagir avec des alcools par des mécanismes similaires.
Lorsqu'un aldéhyde ou un cétona réagit partiellement avec un alcool, des hémiacétaux ou des hémicénétaux. Si la réaction est complètement réalisée, les produits sont des acétals et des cétals. Les équations chimiques suivantes résument et clarifient les nouveaux mentionnés:
Rcho + r3Oh g rchoh (ou3) (Hémiacétal) + R4Oh g rch (ou3) (Ou4) (Acétal)
Rcor2 + R3Oh g rcor2(Oh) (ou3) (Hématique) + r4Oh g rcor2(Ou3) (Ou4) (Ketal)
La première réaction correspond à la formation d'hémiacétaux et d'acétals d'un aldéhyde, et de la seconde hémicétaux et cétaux à partir d'une cétone.
Ces équations ne sont pas assez simples pour expliquer la formation de ces composés; Cependant, pour une première approche du sujet, il suffit de comprendre que les alcools sont ajoutés et que leurs chaînes latérales R (R (R3 et r4) Ils sont liés au carbone carbonyle. C'est pourquoi ou ou3 et ou4 À la molécule initiale.
La principale différence entre un acétal et un kétal, est la présence de l'atome d'hydrogène lié au carbone. Notez que la cétone n'a pas cet hydrogène.
Gars
Très similaire à celle expliquée dans la section de nomenclature pour le groupe carbonyle, ses types sont basés sur les substituants A et B, ou R et R '. Par conséquent, il existe des caractéristiques structurelles qui partagent une série de composés carbonyle au-delà de la commande ou du type de liens.
Par exemple, une mention a été faite au principe d'analogie entre ce groupe et le monoxyde de carbone, C≡O. Si la molécule est dépourvue d'atomes d'hydrogène et s'il y a aussi deux bornes C = O, ce sera alors un oxyde de carbone, CnSOIT2. Pour n égal à 3, vous aurez:
Peut vous servir: IsóbarosO = C = C = C = O
Ce qui est comme s'il y avait deux molécules C≡O liées et séparées par un carbone.
Les composés carbonyle peuvent non seulement dériver de CO Gas, mais aussi de l'acide carbonique, H2CO3 ou oh- (c = o) -oh. Ici, les deux OH représentent R et R ', et le remplacement de l'un d'eux, ou de leurs dérivés d'acide carbononique, ou leurs hydrogènes sont obtenus.
Et puis il y a des dérivés d'acides carboxyliques, RCOOH, obtenus en modifiant les identités R, ou en remplaçant H par un autre atome ou chaîne R '(qui donnerait naissance à un ester, rcoor').
Comment l'identifier dans les aldéhydos et les cétones
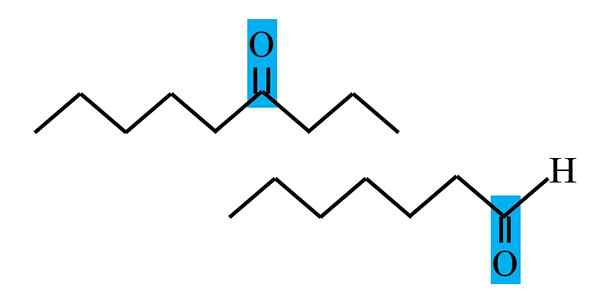 Différenciation de la cétone et de l'aldéhyde d'une formule structurelle. Source: Gabriel Bolívar.
Différenciation de la cétone et de l'aldéhyde d'une formule structurelle. Source: Gabriel Bolívar. Les aldéhydos et les cétones ont en commun la présence du groupe carbonyle. Ses propriétés chimiques et physiques sont dues à lui. Cependant, leurs environnements moléculaires ne sont pas égaux dans les deux composés; Dans le premier, il est en position terminale et dans les secondes, n'importe où dans la chaîne.
Par exemple, dans l'image supérieure, le groupe carbonyle se trouve à l'intérieur d'une boîte bleuâtre. Dans les cétones, à côté de cette boîte, il doit y avoir un autre segment de carbone ou de chaîne (à l'envers); Pendant que dans les aldéhydes, il ne peut y avoir qu'un atome d'hydrogène (ci-dessous).
Si le C = O est à une extrémité de la chaîne, ce sera un aldéhyde; C'est le moyen le plus direct de le différencier d'un Cetona.
IDENTIFIANT
Mais comment savoir expérimentalement si un composé inconnu est un aldéhyde ou une cétone? Il existe de nombreuses méthodes, à partir de tests qualitatifs spectroscopiques (absorption des rayonnements infrarouges, IR) ou organique.
En ce qui concerne les essais qualitatifs, ceux-ci sont basés sur des réactions qui, lorsqu'ils donnent un positif, l'analyste observera une réponse physique; Un changement de couleur, un libération de chaleur, une formation de bulles, etc.
Par exemple, ajoutant à l'échantillon une solution acide de k2Croisement2SOIT7 L'aldéhyde sera transformé en acide carboxylique, ce qui fait passer la couleur de la solution de l'orange au vert (test positif). Pendant ce temps, les cétones ne réagissent pas et, par conséquent, l'analyste n'observe aucun changement de couleur (test négatif).
Un autre essai consiste à utiliser le réactif Tollens, [AG (NH3)2]]+, de sorte que l'aldéhyde réduit les cations Ag+ à Silver en métal. Et le résultat: la formation d'un miroir en argent au bas du tube à essai où l'échantillon a été placé.
Exemples principaux
Enfin, une série d'exemples de composés carbonyle sera répertorié:
-Ch3COOH, acide acétique
-HCOOH, acide formique
-Ch3Coch3, Propanona
-Ch3Coch2Ch3, 2-butanone
-C6H5Coch3, acétophénone
-Ch3Cho, Etanal
-Ch3Ch2Ch2Ch2Cho, pentanal
-C6H5Cho, benzaldéhyde
-Ch3Conh2, acétamide
-Ch3Ch2Ch2COOCH3, Acétate de propyle
Maintenant, si des exemples de composés sont cités qui possèdent simplement ce groupe, la liste serait presque sans fin.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Reid Danielle. (2019). Groupe carbonyle: propriétés et aperçu. Étude. Récupéré de: étudier.com
- Sharleen Agvateesiri. (5 juin 2019). Le groupe carbonyle. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Wiki Kids Ltd. (2018). Composés carbonyle. Récupéré de: simplement.Science
- Toppr. (s.F.). Nomenclature et structure du groupe carbonyle. Récupéré de: toppr.com
- Clark J. (2015). Oxydation des aldéhydes et des cétones. Récupéré de: Chemguide.co.ROYAUME-UNI
- « Biographie José Rubén Romero, style, œuvres
- Notation nucléaire du carbone 12, histoire, commentaires »

