Carbone

- 1333
- 89
- Jade Duval
Qu'est-ce que le carbone?
Il carbone C'est un élément chimique non métallique dont le symbole chimique est C. Son nom est dû au charbon, aux légumes ou aux minéraux, où ses atomes définissent diverses structures. Il forme un large éventail de composés organiques et inorganiques et se présente également dans un nombre considérable d'alotropes.
Le carbone se trouve dans tous les êtres vivants; Toutes ses biomolécules doivent son existence à la stabilité et à la force des liaisons C-C et à leur forte tendance à concaténer. C'est l'élément de la vie, et avec leurs atomes, leurs corps sont construits.
Les composés organiques avec lesquels les biomatériaux sont construits sont constitués de squelettes gazéifiés et hétéroatomes. Ceux-ci peuvent être vus à première vue dans le bois des arbres; Et aussi, lorsque la foudre tombe sur eux et Rostiza. Le solide noir inerte restant a également du carbone; Mais c'est un charbon végétal.
Propriétés du carbone
Les propriétés physiques ou chimiques trouvées dans les solides, les minéraux ou les matériaux carbonés sont soumis à de nombreuses variables. Parmi eux: la composition ou le degré d'impuretés, les hybrides des atomes de carbone, la diversité des structures et la morphologie ou la taille des pores.
Lorsque les propriétés du carbone décrivent, la majorité des textes ou sources bibliographiques sont basés sur le graphite et le diamant.
Parce que? Parce qu'ils sont les alotropes les plus connus pour cet élément et représentent des solides ou des matériaux de haute pureté; c'est-à-dire qu'ils ne sont pratiquement rien fait que des atomes de carbone (bien qu'avec des structures différentes, comme cela sera expliqué dans la section suivante).
Les propriétés du charbon végétal et minéral diffèrent respectivement par leurs origines ou leurs compositions,. Par exemple, le lignite (carbone pauvre) comme carburant Gatea par rapport à l'anthracite (riche en carbone). Et que dire des autres alotropes: nanotubes, fullerrenos, graphène, graphos, etc.
Cependant, ils ont chimiquement un point commun: ils oxydent avec un excès d'oxygène dans le CO2:
C + SOIT2 => CO2
Maintenant, la vitesse ou la température dont ils ont besoin pour oxyder sont possédées pour chacun de ces alotropes.
Graphite vs diamant
Ici, un bref commentaire sera également fait concernant les différentes propriétés de ces deux alotropes:
 Table dans laquelle certaines propriétés des deux alotrops cristallins de carbone sont comparées. Source: Gabriel Bolívar.
Table dans laquelle certaines propriétés des deux alotrops cristallins de carbone sont comparées. Source: Gabriel Bolívar. Structure et configuration électroniques
Hybrides
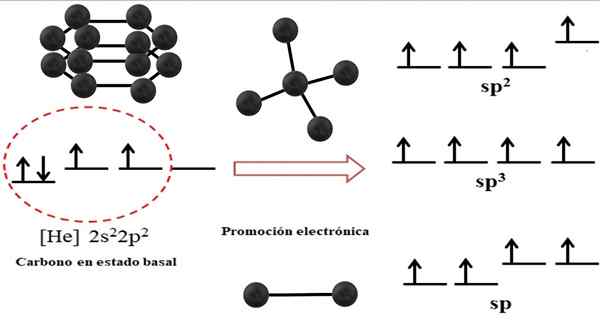 Relation entre les orbitales hybrides et les structures possibles pour le carbone. Source: Gabriel Bolívar.
Relation entre les orbitales hybrides et les structures possibles pour le carbone. Source: Gabriel Bolívar. La configuration électronique de l'atome de carbone est 122s22 P2, Aussi écrit comme [il] 2s22 P2 (image supérieure). Cette représentation correspond à son statut basal: l'atome de carbone isolé et suspendu dans un tel vide qui ne peut pas interagir avec les autres.
Peut vous servir: structure cristallineIl est apprécié que l'une de ses orbitales 2p manque d'électrons, qui accepte un électron de l'orbitale d'énergie moindre par promotion électronique; Et ainsi, l'atome acquiert la capacité de former jusqu'à quatre obligations covalentes à travers ses quatre orbitales hybrides SP3.
Notez que les quatre orbitales sp3 Ils sont dégénérés en énergie (alignés au même niveau). Les orbitales p Les purs sont plus énergiques, c'est pourquoi ils sont au-dessus des autres orbitales hybrides (à droite de l'image).
S'il y a trois orbitales hybrides, c'est parce qu'une orbitale reste p sans hybridation; Par conséquent, ce sont trois orbitales sp2. Et quand il y a deux de ces orbitales hybrides, deux orbitales p Ils sont disponibles pour former des liaisons doubles ou triples, étant l'hybridation du carbone F.
De tels aspects électroniques sont essentiels pour comprendre pourquoi le carbone peut être trouvé dans les infinités alotropes.
Nombres d'oxydation
Avant de continuer avec les structures, ce n'est pas d'autres à mentionner que, compte tenu de la configuration électronique de Valencia 2S22 P2, Le carbone peut avoir les numéros d'oxydation suivants: +4, +2, 0, -2 et -4.
Parce que? Ces nombres correspondent à l'hypothèse qu'il existe une obligation ionique telle que vous formez les ions avec les charges respectives; c'est-à-dire C4+, C2+, C0 (neutre), c2- et C4-.
Pour que le carbone ait un nombre d'oxydation positif, il doit perdre des électrons; Et pour le faire, il doit nécessairement être lié à des atomes très électronégatifs (comme l'oxygène).
Pendant ce temps, pour que le carbone ait un nombre d'oxydation négatif, il doit gagner des électrons liés à des atomes métalliques ou moins électronégatifs que lui (comme l'hydrogène).
Le premier problème d'oxydation, +4, signifie que le carbone a perdu tous les électrons de valence; Les orbitales 2 et 2p sont vides. Si l'orbital 2p perd ses deux électrons, le carbone aura +2 numéro d'oxydation; Si vous gagnez deux électrons, vous aurez -2; Et s'il gagne deux électrons en plus terminant son octet de Valencia, -4.
Exemples
Par exemple, pour CO2 Le nombre d'oxydation du carbone est de +4 (car l'oxygène est plus électronégatif); tandis que pour Cho4, est -4 (parce que l'hydrogène est moins électronégatif).
Peut vous servir: hydrazine: structure, propriétés, synthèse, utilisationsPour ch3Oh, le nombre d'oxydation du carbone est -2 (+1 pour H et -2 pour O); Tandis que pour HCOOH, c'est +2 (vérifiez que la somme de 0).
D'autres états d'oxydation, tels que -3 et +3, sont également probables, surtout en ce qui concerne les molécules organiques; Par exemple, dans les groupes méthyles, -ch3.
Géométries moléculaires
Dans l'image supérieure, non seulement l'hybridation des orbitales pour l'atome de carbone a été montrée, mais aussi les géométries moléculaires résultantes lorsque plusieurs atomes (sphères noires) sont liés à un centre. Cet atome central pour éliminer un environnement géométrique spécifique dans l'espace doit posséder l'hybridation chimique respective qui est autorisée.
Par exemple, pour le tétraèdre, le carbone central a une hybridation SP3; Parce que tel est l'agencement le plus stable pour les quatre hybrides SP3. Dans le cas des carbones SP2, Ils peuvent former des liens doubles et éliminer un environnement plat trigonal; Et donc, ces triangles définissent un hexagone parfait. Et pour une hybridation SP, les carbones adoptent la géométrie linéaire.
Ainsi, les géométries observées dans les structures de tous les alotropes sont simplement régies en tétraède (SP3), des hexagones ou des pentagones (SP2), et les lignes (sp).
Les tétraèdres définissent une structure 3D, tandis que les hexagones, les pentagones et les lignes, les structures 3D ou 2D; Ces derniers deviennent les plans ou les feuilles similaires aux murs des nid d'abeilles d'abeilles:
 Mur avec designs hexagonaux d'un nid d'abeille d'abeille en analogie avec les plans composés de carbones SP2. Source: Pixabay.
Mur avec designs hexagonaux d'un nid d'abeille d'abeille en analogie avec les plans composés de carbones SP2. Source: Pixabay. Et si nous replions cette paroi hexagonale (pentagonale ou mixte), nous obtiendrons un tube (nanotubes) ou une balle (fullerène), ou une autre figure. Les interactions entre ces chiffres donnent lieu à différentes morphologies.
Solides amorphes ou cristallins
Laissant des géométries, des hybridations ou des morphologies des structures de carbone possibles, leurs solides peuvent se classer à l'échelle mondiale en deux types: amorphe ou cristallin. Et entre ces deux classifications, leurs alotropes sont distribués.
Le carbone amorphe est simplement celui qui présente un mélange arbitraire de tétraèdre, d'hexagones ou de lignes, incapable d'établir un modèle structurel; C'est le cas du charbon, des légumes ou du charbon actif, du coke, de la suie, etc.
Tandis que le carbone cristallin se compose de modèles structurels formés par l'une des géométries soulevées; Par exemple, le diamant (réseau de tétraèdre à trois dimensions) et le graphite (feuilles hexagonales empilées).
Peut vous servir: nitrate de sodium (nano3): structure, propriétés, utilisations, risquesOù est le carbone?
En plus d'être l'élément chimique commun dans toutes les formes de vie, le carbone est présent sous trois formes cristallines: diamant, graphite et guide.
Il existe également plusieurs formes minérales de charbon amorphes (anthracite, lignite, muette, tourbe), formes liquides (variétés de pétrole) et de soude (gaz naturel).
Applications
Encore une fois, comme les propriétés et la structure, les utilisations ou les applications sont cohérentes avec les alotrogos ou les formes de carbone minéralogiques. Cependant, certaines généralités peuvent être mentionnées, en plus de certains points très connus. Tels sont:
-Le carbone est utilisé depuis longtemps comme agent de réduction des minéraux dans l'obtention de métaux purs; Par exemple, le fer, le silicium et le phosphore, entre autres.
-C'est la pierre angulaire de la vie, et la chimie organique et la biochimie sont les études de cette réflexion.
-Ce fut également un combustible fossile qui a permis aux premières machines d'aller à leurs engrenages. De la même manière, le gaz carbone pour les anciens systèmes d'éclairage a été obtenu de lui. Le charbon était synonyme de lumière, de chaleur et d'énergie.
-Mélangé en additif avec du fer dans différentes proportions a permis l'invention et l'amélioration des aciers.
-Sa couleur noire a eu lieu dans l'art, en particulier le graphite et tous les écrits réalisés avec leurs traits.
Risques et précautions
Le carbone et ses solides ne représentent aucun risque pour la santé. Qui s'est inquiété d'un sac à charbon? Ils les vendent à beaucoup dans les couloirs de certains marchés, et tant qu'il n'y a pas près de feu, leurs blocs noirs ne brûlent pas.
Le coke, en revanche, peut représenter un risque si sa teneur en soufre est élevée. Lorsque la combustion libère des gaz soufrés qui, en plus d'être toxiques, contribuent aux pluies acides. Et bien que le CO2 En petites quantités, il ne peut pas nous suffoquer, il a un impact énorme sur l'environnement en tant que gaz à effet de serre.
De ce point de vue, le carbone est un danger "à long terme", car sa combustion modifie le climat de notre planète.
Et dans un sens plus physique, des solides ou des matériaux carbonés s'ils sont pulvérisés sont facilement transportés par des courants d'air; Et par conséquent, ils sont initiés directement aux poumons, ce qui peut les endommager de manière irrémédiable.
Du reste, il est très courant de consommer du «charbon» lorsque des aliments cuisent.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- « Caractéristiques lagomorphes, aliments, reproduction, habitat
- Qu'est-ce qui est, dans la mitose, dans la méiose »

